


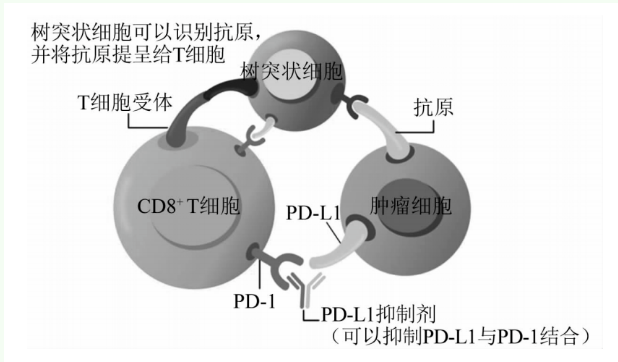
正文 树突状细胞(dendritic cell,DC)是体内功能最强的专职APC,除在机体的固有免疫应答中发挥重要作用外,还负责启动适应性免疫应答并影响免疫应答的类型,协助发挥免疫效应。DC膜表面具有丰富的MHCⅠ类(MHC-Ⅰ)和Ⅱ类(MHC-Ⅱ)、共刺激分子(CD80/B7-1、CD86/B7-2、CD40、CD40配体等)和细胞间黏附分子(intercellular cell adhesion molecule,ICAM)-1、ICAM-2、ICAM-3以及淋巴细胞功能相关分子-1等,能刺激初始T细胞活化增殖。根据体外对DC功能特性、定位及原位属性等研究结果,并基于其表型、关键基因特征包括关键转录因子、Toll样受体(Toll-like receptor,TLR)和其他功能相关的分子如趋化因子受体、C型凝集素受体(C-type lectin receptor,CLR)及个体发展等研究信息综合分析后,将DC分为经典DC(conventional DC,cDC)、浆细胞样DC(plasmacytoid DC,pDC)、朗格汉斯细胞(Langerhans cell,LC)、炎症DC(inflammatory DC,infDC)4种亚群[1]。正常生理状态下,DC在体内数量较少但广泛分布,且大多处在未活化状态。当机体发生感染或炎症时,未成熟的DC迅速成熟,有效地激活初始T细胞产生抗原特异性应答。本文综述DC的激活及重要激活机制,同时回顾DC在肿瘤、动脉粥样硬化、巨细胞病毒(cytomegalovirus,CMV)感染及其他病症中的作用。 1 DC的活化及其机制 1.1 DC的来源与分化 DC来源于骨髓多能造血干细胞,其起源、分化途径见图1。造血干细胞分化为淋巴干细胞和髓样干细胞后,髓样干细胞在粒细胞-巨噬细胞集落刺激因子(granulocyte-macrophage colony stimulating factor,GM-CSF)的刺激下分化为髓样DC(myeloid DC,MDC)。单核细胞与MDC拥有相同前体细胞,均来源于造血干细胞,在GM-CSF和IL-4的诱导下可产生外周血单核细胞来源的DC。淋巴样干细胞为CD34+细胞,分化成淋巴样DC的过程严重依赖于细胞因子FMS样酪氨酸激酶3配体(FMS-like tyrosine kinase 3 ligand,FLT3L),经FLT3L处理后,不同DC亚群的比率都显著增加[1]。FLT3L是一种诱导DC分化和存活的造血细胞因子,Ding等[2]研究发现,人类FLT3L处理人源化非肥胖性糖尿病/重症联合免疫缺陷小鼠后,显著增强人类DC亚群的重建,可在体内产生大量CD1c+和CD141+ DC亚群。大多数DC由共同DC祖细胞(common DC progenitor,CDP)生成。CDP在FLT3L诱导下产生cDC前体和pDC前体,最终生成为cDC或pDC[3]。cDC含cDC1和cDC2两个亚群,在发育和功能上均不同。cDC1能够进行抗原交叉呈递和激活CTL,这些T淋巴细胞是细胞免疫的关键效应器。cDC2是细胞外病原体的APC,促进各种Th,包括Th2和Th17分化,因此在体液和细胞免疫中发挥着重要作用[4]。pDC的特征是能产生高剂量的Ⅰ型干扰素,在抗病毒免疫中发挥作用。Vremec等[5]研究发现,大多数淋巴组织的DC可以在GM-CSF缺失或没有相关信号的情况下,通过GM-CSF受体的共同β链的相关信号刺激活化或分化增殖。 1.2 DC的特征和免疫调节能力 近年的研究表明,DC表面未发现T细胞(CD3)、B细胞(CD19、CD20)、自然杀伤(natural killer,NK)细胞(CD56)、单核细胞(CD14、CD16)、粒细胞和中性粒细胞(CD66b)或干细胞(CD34)等已知谱系的特异性标志物,但DC能够高水平表达MHC-Ⅱ,人类DC通常以表达HLA DR抗原为特征,DC能够高水平表达的另一个重要分子是跨膜蛋白CD11c。DC的识别特征为共刺激分子的表达,特别是对成熟DC[1]。CD40是DC上重要的共刺激分子,其配体CD40L通常由活化的CD4+和CD8+ T细胞表达。CD40-CD40L相互作用上调共刺激分子CD80和CD86的表达,并在DC中诱导出完全成熟的表型。CD40还诱导DC产生IL-12,促进初始T细胞大量增殖分化成Th1[6]。 DC的免疫调节能力与DC表面受体的模式识别和免疫调控有关,其中TLR和CLR得到广泛关注。TLR在适应性免疫中发挥重要作用,DC可以表达TLR并借助TLR识别具有病原相关分子模式的蛋白质,从而提供共刺激信号,促使启动适应性免疫应答。CLR含有钙离子依赖糖识别域,作为CLR一员的DC特异性细胞间黏附分子-3结合非整合素因子(DC-specific intercellular adhesion molecule 3-grabbing non-integrin,DC-SIGN)属Ⅱ型跨膜蛋白,普遍存在于人体的DC中,广泛参与固有免疫和适应性免疫的调节,DC-SIGN被证明是多种病原体的关键锚点,HIV病毒颗粒能够与DC-SIGN相结合,促进其在脂多糖的帮助下内化,从而引导溶酶体间质降解,并且使病毒能够在DC共同受体和自身的糖蛋白间建立复杂的相互作用关系。全球COVID-19仍肆虐的环境,将会大大促进对DC-SIGN和其他凝集素的作用机制研究并获得关键性突破[7]。 1.3 DC激活的相关影响因素 DC的激活受到多种因素的影响,这些因素可以通过不同的方式对DC的激活产生作用。瘦素是一种脂肪分泌的激素,在代谢和免疫中都起着重要作用,对于DC激活和完全成熟至关重要。Bai等[8]发现,瘦素可以糖酵解方式增强DC的免疫功能,并可以激活信号传导及转录激活蛋白3通路上调己糖激酶2表达量,从而提高DC的糖酵解能力。 参与细胞骨架重排、调节恶性肿瘤迁移和侵袭的开关相关蛋白70(switch-associated protein 70,SWAP-70)是一种鸟嘌呤核苷酸交换因子,Ocaña-Morgner等[9]研究表明,SWAP-70是控制DC自发成熟的重要分子,在DC中,SWAP-70控制MHC-Ⅱ的上调及迁移至鞘氨醇-1-磷酸信号途径,还可以抑制DC的自发成熟,SWAP-70的缺失会导致表达高水平的T细胞刺激分子的DC数量增加。 2 DC与多种疾病的关系 DC是体内功能最强的专职性APC,除在机体的固有免疫和适应性免疫应答中发挥重要作用外,还影响免疫应答的类型,协助发挥强大的免疫效应。 2.1 DC与肿瘤 2.1.1 CTL激活 恶性肿瘤是对人类健康的极大挑战,迫切需要安全有效的治疗方法。对DC亚群及其功能的深入研究发现,DC与肿瘤有着密切关系。DC可通过识别和浸润肿瘤,分泌调节肿瘤微环境的可溶性因子,并呈递肿瘤相关抗原(tumor-associated antigen,TAA),促发T细胞应答,提高机体抗肿瘤的免疫功能。其中的CD8+ CTL就是一种接受了DC抗原呈递的特异性肿瘤杀伤T细胞,其分布可位于肿瘤的侵袭性边缘,也可位于肿瘤的核心部位,并专门分泌多种细胞因子发挥免疫应答的效应。CD8+ CTL对某些病毒、肿瘤细胞等具有杀伤作用,与NK细胞构成机体抗病毒与抗肿瘤免疫的重要防线[10]。 CD8+ CTL通常是抗肿瘤免疫的主要效应细胞,而通过DC促进TAA交叉递呈被认为是最重要且最关键的环节。Wculek等[11]近期的研究进一步揭示,由cDC1呈递的抗原交叉性更强,诱导的CD8+ CTL免疫效应更高;此外,还能支持CD4+ T细胞的Th1极化。针对DC在介导T细胞对肿瘤免疫中的核心作用,研究者们开展了基于DC的多项临床试验,证明肿瘤的发生与发展不仅是肿瘤细胞自身不断改变,更是机体作为一个生物系统的整体平衡失调所致。肿瘤具有维持免疫抑制微环境作用,很难被排斥。机体的免疫系统会抑制免疫过度激活,避免因其导致的自身组织损害,但肿瘤组织会利用这一系列变化,导致机体产生自身免疫耐受以逃避免疫系统对它的识别和排斥。程序性死亡蛋白1(programmed death-1,PD-1)是重要的免疫抑制分子,能够抑制T细胞活化来维持外周耐受。PD-1的配体有程序性死亡蛋白配体(programmed death ligand,PD-L)1和PD-L2,PD-1和PD-L1结合启动T细胞的程序性死亡。DC等健康细胞表面含有PD-L1,可预防自身免疫性疾病。然而,肿瘤细胞表面同样含有PD-L1,与PD-1结合后可诱导T细胞凋亡,从而抑制CD8+ CTL抗肿瘤功能,实现肿瘤免疫逃逸[12]。近年来,临床上肿瘤免疫治疗的发展已经到达了一个重要转折点[13],如免疫检查点抑制剂最近已被证明对肿瘤有效,其可以封闭免疫检查点,从而活化T细胞功能,提高肿瘤免疫。为了阻断PD-1/PD-L1途径,常使用PD-1抑制剂和PD-L1抑制剂。PD-L1抑制剂能够抑制PD-L1与PD-1结合,从而使T细胞正常发挥作用[14],见图2。 其他蛋白也可以通过DC影响T细胞功能。多聚嘧啶区结合蛋白1(polypyrimidine tract binding protein 1,PTBP1)作为DC功能性调节因子,具有调节T细胞稳态的功能,若缺失可干扰免疫稳态。Geng等[15]发现,RNA结合PTBP1可以调节DC中丙酮酸激酶同工酶的选择性剪切,DC中PTBP1的特异性缺失可导致MHC-Ⅱ表达增强,使活化T细胞数量增加而不损害DC的发育,缺乏PTBP1也可增强DC的功能,从而增强其抗肿瘤免疫的效力。DC还可以通过模式识别受体感知环境抗原,如TLR导致MHC-Ⅱ、CD80和CD86的表达上调,然后迁移到淋巴器官激活T细胞[16-17]。缺氧诱导因子-1(hypoxia inducible factor-1,HIF-1)是具有转录活性的核蛋白,能够在缺氧应激的代谢适应中发挥重要作用。Pang等[18]研究发现,肿瘤来源的腺苷可选择性激活pDC,并通过HIF-1αCD39/CD73信号通路协调该细胞的运输和免疫原性,激活的pDC可促进CD8+ CTL的衰竭和Treg的诱导。 2.1.2 DC疫苗 针对肿瘤抗原的DC疫苗旨在提高患者对自身肿瘤的免疫应答,20世纪90年代的临床前研究首次引入了使用自体骨髓源性DC作为疫苗的概念,并主张使用体外生成的DC,而不是肽类疫苗来产生有效的CD4+和CD8+ T细胞介导的肿瘤免疫,为DC疫苗奠定了基础[19]。尽管DC肿瘤疫苗策略已经在许多临床试验中被证明有效,但是一些问题仍有待解决。Saadeldin等[20]总结了强化应用DC疫苗需要关注的问题,包括:对有统计学意义的目标患者,最终TAA在癌细胞和正常细胞中有显著不同的表达水平;疫苗接种中使用的表位的数量和性状(无论是多个表位还是单个表位);抑制肿瘤微环境中的促肿瘤调节机制或激活抗肿瘤机制,以提高癌症疫苗作用。 2.2 DC与动脉粥样硬化 心血管病是全球多个国家人口死亡的主要原因之一,据我国国家心血管病中心发布的《中国心血管病报告2018》显示,在中国心血管病仍居死亡率首位,农村心血管病死亡率为309.33/10万,城市心血管病死亡率为151.18/10万[21]。冠状动脉疾病和脑血管疾病是最常见的心血管病形式,其发生发展的病理过程是动脉粥样硬化(atherosclerosis,AS)。AS是一种慢性炎症性疾病,参与动脉壁内胆固醇和脂肪沉积物的堆积,限制了血液流向心脏、大脑和肺等重要器官[22]。AS的起始标志是氧化低密度脂蛋白(oxidized low density lipoprotein,Ox-LDL)诱导泡沫细胞及血管壁脂纹形成,Ox-LDL引发的重要血管发生的固有和适应性免疫应答是引起炎症反应和病理后果的主要原因。在正常动脉血管壁中,常驻DC可使T细胞失活失能,促进其对抗原产生耐受性;但在AS的发生发展过程中产生的危险信号能激活DC,启动T细胞由耐受性状态转入适应性免疫的激活状态[23-24]。由此可见,血管中的DC在AS形成过程中具有重要的调控作用,已成为抗AS治疗的新靶点[25]。DC可以参与AS的全过程,曾有研究证实,巨噬细胞在AS进展中发挥重要作用;但近期的发现清晰展示,DC与AS的发生发展更密切。已有研究在动脉壁中观察到DC,并且发现该细胞能够摄取动脉壁中的脂质,有益于AS的逆转和康复[26]。 2.3 DC与CMV感染 人CMV(human CMV,HCMV)属于β疱疹病毒亚科,在人群中感染非常普遍,能够导致大多数人群的感染。原发性HCMV感染在免疫力强的个体中可能无临床症状或表现为自限性发热疾病。在原发性感染后,HCMV作为潜伏性病毒,能够重新被激活并传播给易感个体[27]。DC作为最有效的专职APC,能够启动多种T细胞的免疫应答。对HCMV和小鼠CMV(murine CMV,MCMV)的独立研究分别报道了观察结果,发现MCMV感染后,DC的液相内吞能力受损,受感染的DC失去了捕获抗原的能力,这是不成熟DC的特性;而HCMV的感染则抑制了DC的成熟[28]。为进一步了解DC在CMV感染中的作用,Mathys等[29]用表达绿色荧光蛋白的重组MCMV感染不同成熟阶段的小鼠正常骨髓源的混合DC贴壁细胞,发现MCMV感染导致DC在感染后早期被激活,初始激活后的DC具有特异性下调抗原呈递给初始T细胞表面蛋白的作用,并且还观察到,未成熟和成熟的DC均可被MCMV感染且感染效率相似。证明了DC在MCMV感染过程中具有双重作用,即产生特异性免疫应答的同时也启动了免疫抑制。 髓样分化因子88(myeloid differentiation factor 88,MyD88)是TLR信号通路中的主要接头蛋白,TLR9是TLR家族中的一员,能够与MyD88相互作用。Puttur等[30]构建了在造血细胞或非造血细胞中缺乏TLR9和MyD88的骨髓嵌合小鼠以及在CD11c+细胞中选择性缺乏TLR9或重新激活MyD88的转基因小鼠,证明CD11c+DC中的TLR9/MyD88信号选择性地通过提高NK细胞CD69的表达和IFN-γ产生,显著增强MCMV清除效果;进一步发现,在没有pDC的情况下,cDC以TLR9/MyD88途径增强了NK细胞功能和MCMV清除效果。MCMV感染后的NK细胞脱颗粒和细胞毒性能力与TLR9/MyD88和Ⅰ型干扰素无关,cDC与TLR9/MyD88途径的关系有待进一步探索。 2.4 DC与其他疾病 DC在许多疾病中都发挥着重要作用,在细菌或病毒感染期间,cDC1对诱导保护性免疫起着关键作用,能够抵抗来自HIV和流感病毒等包膜病毒的感染,还具有控制HCV感染的作用[1];cDC还能够在周围组织中寻找病原体,分泌细胞因子、呈递抗原并激活初始T细胞,并且在诱导、维持中枢和外周的自我耐受以及最大限度地减少自身免疫应答中发挥作用。pDC在系统性红斑狼疮的始发过程中发挥重要作用[31],而且参与Ⅰ型糖尿病的诱导。此外,pDC还参与肿瘤免疫逃逸,并且在多种自身免疫性疾病的发病机制中都起着重要作用[32]。据报道,LC与组织细胞增多和特异性皮炎相关,该细胞发生炎症反应受胸腺淋巴生成素的调节,能促进过敏性T细胞亚群的增殖与分化[33]。infDC与特异性皮炎、银屑病、类风湿关节炎有关,并在微生物感染中发挥关键作用。 3 展望 DC自发现以来,一直是研究人员关注的热点。综上所述,DC作为体内功能最强的专职性APC,并且是已知的唯一能够激活未致敏的初始T细胞的APC,在固有免疫和获得性免疫中发挥重要作用。DC来源有两种,由GM-CSF刺激髓样干细胞分化或来源于淋巴样干细胞,目前被分为cDC、pDC、LC和infDC这4个亚群,每个亚群的作用机制有待进一步研究。恶性肿瘤作为困扰人类的一大难题,PD-1免疫检查点阻断疗法已进入临床治疗;但近期的追踪研究发现,该疗法有损免疫记忆CD8+ T细胞,不利于肿瘤的治疗和免疫[34]。如何将基础研究安全高效地应用于临床,亟待解决。研究发现,pDC参与肿瘤免疫并可制备成DC肿瘤疫苗应用于临床,为今后研究肿瘤免疫的兴起提供了一个更加清晰的思路。
