


前言
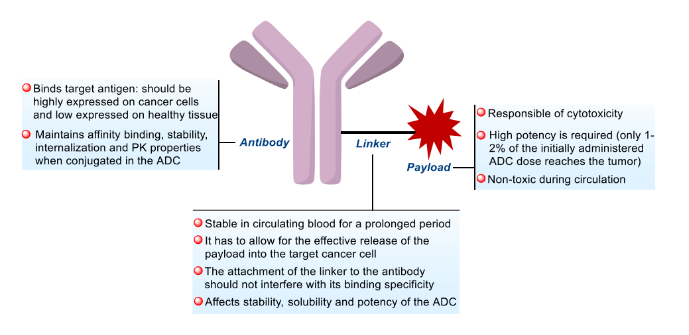
抗体偶联药物(ADC)是由靶向特异性抗原的单克隆抗体与小分子细胞毒性药物通过连接子链接而成,兼具传统小分子化疗的强大杀伤效应及抗体药物的肿瘤靶向性。ADC由三个主要部分组成:负责选择性识别癌细胞表面抗原的抗体,负责杀死癌细胞的药物有效载荷,以及连接抗体和有效载荷的连接子。
ADC对抗原的识别导致ADC通过内吞途径进入细胞内,通过溶酶体降解后,有效载荷以生物活性形式释放并发挥作用,导致癌细胞死亡。细胞内有效载荷的数量由每个细胞表面抗原的数量、每个ADC的药物有效载荷分子的数量(也称为药物抗体比率,DAR)以及抗原返回细胞表面所需的时间决定。有效载荷可能在癌细胞死亡和降解后逃逸,也可能从胞浆中透膜而出。这种释放的后果可能是有益的(也称为旁观者效应),也可能是有害的,导致全身毒性。
ADC领域使用的细胞毒性药物主要有两类。第一类是破坏微管组装并影响有丝分裂的微管抑制剂;如auristatin和DM1。第二类是DNA损伤药物,如PDB和杜卡霉素。在已获批的ADC药物使用的有效载荷中,MMAE和MMAF是来自于海洋生物的天然毒素。海洋丰富的生物资源为ADC药物的有效载荷提供了更多的选择,展现出诱人的前景。
1987年,Pettit等人从海兔中首先分离出了dolastatin 10,其抗癌作用机制是其抑制微管蛋白聚合的能力,以非竞争方式结合长春花生物碱位点。Auristatin E是dolastatin 10的最佳类似物之一。此外,单甲基氨基dolastatin 10(MMAD)被鉴定为与dolastatin 10活性相同的有效类似物。因此,在2000年批准Mylotarg治疗急性髓系白血病的鼓励下,SeaGen启动了一项研究计划,旨在设计和合成基于auristatin E的ADC。2011年,FDA批准了brentuximab vedotin(Adcetris),证明了MMAE作为有效载荷的有效性。
目前已批准或正在进行临床试验的使用vedotin的ADC主要包括:(1)Enfortumab vedotin(Padcev),靶向nectin-4,2019年被批准用于治疗局部晚期或转移性尿路上皮癌的成年患者;(2)Polatuzumab vedotin(Polivy),靶向CD79B,2019年被批准用于治疗大B细胞淋巴瘤的患者;(3)Tisotumab-vedotin(Tivdak),靶向组织因子TF-011, 2021被批准用于治疗复发或转移性宫颈癌的女性患者;(4)Disitamab-vedotin,靶向人表皮生长因子受体2(HER2),在中国被批准用于治疗HER2过表达的局部晚期或转移性胃癌患者;(5)Septuximab vedotin,靶向人FZD7,处于临床前阶段,正在体外和体内针对卵巢癌模型;(6) Promiximab vedotin,靶向CD56,正在体外和体内针对表达CD56的小细胞肺癌(SCLC)异种移植小鼠模型中进行评估;(7)Pinatuzumab vedotin,靶向CD22,正在进行治疗非霍奇金淋巴瘤的II期临床试验。
与单甲基auristatin E相关,其他Auristatin类似物也被选择并用作其他ADC的有效载荷,如auristatins F、M和W、Auristatin F的单甲基类似物(MMAF)、PF-06380101、duostatin 5或酮基Auristatin PE(KAPE)。其中基于MMAF的belantamab mafodotin(Blenrep),于2020年被FDA批准用于治疗复发或难治性骨髓瘤的成人患者。
halichondrins最初是从日本海绵中分离出来的,其特征是含有2,6,9-三氧三环癸烷环系统的高度复杂的聚醚大环内酯。
其中halichondrin B是最丰富和重要的成员,Halichondrin B在体外对B-16黑色素瘤细胞显示出高效力(IC50为0.093ng/mL),在纳摩尔浓度下对几种癌细胞系具有有效的抗增殖作用。Halichondrin B的作用模式基于天然产物与微管蛋白的相互作用,形成微管蛋白聚集体,微管的组装被抑制,进而导致细胞周期G2-M期停滞和细胞凋亡。
最初人们从相关海绵中分离halichondrin B,然而极低的产率阻碍了相关研究。该问题通过全合成得到解决,人们确定了halichondrin B的最小药效基团,进一步的结构和生物学优化最终合成了eribulin,其结构比halichondrin B更简单。甲磺酸eribulin(Halaven)已于2010年在美国被批准用于治疗转移性乳腺癌,迄今已在约70个国家获得批准。
由于其出色的抗肿瘤活性,eribulin已成为ADC的有效载荷。MORAb-002是一种靶向叶酸受体α(FRA)的ADC,利用了eribulin作为细胞毒性有效载荷。FRA是一种糖基磷脂酰肌醇(GPI)连接蛋白,在各种上皮性恶性肿瘤(包括卵巢癌、肺癌和乳腺癌)中过表达,而在正常组织中基本不存在。MORAb-002选择farletuzumab作为人源化抗人FRA单克隆抗体,并选择了组织蛋白酶B可切割的Val-Cit-PAB连接子。
MORAb-202在小鼠的非小细胞肺癌和胃癌的PDX模型中进行了体内研究,在5mg/kg剂量下显著抑制了肿瘤生长。此外研究还表明,MORAb-202在体外表现出明显的旁观者细胞毒性作用,并且在体外对FRA阳性细胞具有高度细胞毒性,对FRA阴性细胞的靶外杀伤有限。最近,MORAb-202的1期临床试验公布了初步结果,显示MORAb-202耐受性良好,毒性轻微。此外,MORAb-202能够对标准治疗无效后复发的各种肿瘤(卵巢癌、子宫内膜癌、三阴性乳腺癌和非小细胞肺癌)产生影响。目前正在扩大第一阶段的研究。
PM050489及其脱氯类似物PM060184是PharmaMar从马达加斯加海绵中分离的两种海洋天然产物。其结构特征是α、β-不饱和δ-内酯、共轭三烯和L-叔亮氨酸,通过(Z)-烯酰胺连接到含有氨基甲酸亚基的二烯。这两种聚酮在人类癌细胞系中均表现出良好的体外活性,并具有强大的抗有丝分裂活性。
PharmaMar合成并表征了基于PM050489的两种ADC:MI130004和MI130110。MI130004基于PM050489与曲妥珠单抗的偶联,而MI130110是PM050499与抗CD13的抗体TEA1/8的偶联。两种ADC均使用基于马来酰亚胺的不可裂解连接子。
目前,两种ADC均处于临床前研究阶段。MI130004在乳腺、胃和卵巢的癌细胞系中显示出显著的体外抗增殖活性。MI130110在体外对表达CD13的癌细胞显示出选择的抗增殖活性。此外,在CD13阳性的纤维肉瘤小鼠模型中,MI130110显示出优异的抗肿瘤活性和完全缓解,这些结果证明了这些ADC的抗肿瘤治疗潜力。
2003年,人们从海洋海鞘中发现了shishijimicin A以及其他相关成员shishijimicins B、C和namenamicin,并认识到它们令人印象深刻的抗肿瘤特性。
因此,人们开始探索shishijimicin A分子作为ADC有效载荷的抗肿瘤潜力。通过引入三种抗体以shishijimicin A类似物制备ADC,靶向高表达和良好内吞性质的细胞表面蛋白T1和T2,,产生了DAR为2的均质ADC。令人满意的是,这些ADC在相关细胞系中均显示出优异的特异性细胞毒性。目前,正在小鼠模型中进行进一步的深入研究。
1993年,人们从太平洋海岸采集的海兔中分离出了Aplyronine A-C,并阐明了它们的分子结构,实现了Aplyronine A、B和C的全合成。Apyronine A抑制肌动蛋白,从而调节细胞功能,如细胞分裂或肌肉收缩。Aplyronine A的作用模式是基于通过1:1:1异三聚体复合物的相互作用抑制微管组装,抑制癌细胞的纺锤体形成和有丝分裂,显示了其作为抗肿瘤药物的潜力。相关ADC药物的研究处于临床前阶段。
ADC从最初的Ehrlich的“魔法子弹”概念经过几十年在今天终于成为现实。在过去的十年中,ADCs已经通过选择更好的细胞毒性药物、生物偶联方法、更好的靶向抗原和优化的抗体工程得到了改进。
目前,已有10多个ADC获得临床批准,100多个ADC正在进行临床评估。特别是,一些ADC的有效载荷是来自海洋生物的天然产物和类似物,并且已证明其具有前所未有的分子结构和令人印象深刻的生物特征。未开发的海洋世界的强大力量,将是未来开发新型ADC的最大灵感来源。来自海洋世界的无限机会,加上ADC领域的巨大势头,将保证此类疗法的黄金未来。
