


前言
间充质干细胞(MSCs)是一种自我更新的多能干细胞,可调节参与抗肿瘤免疫的所有免疫细胞的表型和功能。MSCs调节树突状细胞的抗原呈递特性,影响巨噬细胞和CD4+T辅助细胞中趋化因子和细胞因子的产生,改变CD8+T淋巴细胞和自然杀伤细胞的细胞毒性,并调节髓源性抑制细胞和T调节细胞的产生和扩增。
作为可塑性细胞,MSC根据邻近肿瘤浸润免疫细胞的细胞因子决定其表型和功能。根据其所暴露的肿瘤微环境,MSC可获得促肿瘤和抗肿瘤表型,从而增强或抑制肿瘤生长。由于其肿瘤归巢特性,MSC及其外泌体可作为在肿瘤细胞中输送抗肿瘤药物的载体,降低肿瘤的生存能力和侵袭性。
因此更好地理解调节MSCs、免疫细胞和肿瘤细胞之间相互作用的信号通路将为MSCs在肿瘤免疫治疗中的临床应用铺平道路。
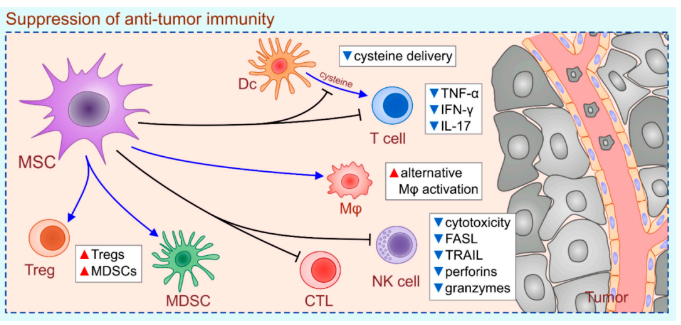
一些证据表明,肿瘤相关MSCs(CA-MSCs)和外源性给药的MSCs通过以下方式促进肿瘤生长:(i)阻止幼稚T细胞的DC依赖性激活,(ii)诱导TAM的选择性激活,(iii)调节辅助性T细胞中细胞因子的产生;(iv)下调CTL和NK细胞的细胞毒性;(v)促进Treg和MDSCs的生成和扩增。
研究证明,CA-MSCs以旁分泌、IL-10和STAT-3依赖的方式抑制幼稚T细胞的DC依赖性激活。CA-MSC衍生的IL-10通过阻断DC向同源T淋巴细胞提供半胱氨酸的能力,抑制DC诱导的T细胞增殖。此外,CA-MSC衍生的IL-10诱导DC中STAT-3的磷酸化,磷酸化的STAT-3抑制IFN-γ激活序列(GAS),该序列也是胱硫醚酶启动子序列。因此,DC衍生的半胱氨酸到T细胞受到抑制,导致T细胞增殖和活化减少,缺乏半胱氨酸也显著减弱了T细胞中IFN-γ的产生。
MSCs、M1型和M2型巨噬细胞之间的相互作用对MSC依赖性调节肿瘤进展起着至关重要的作用。M1型巨噬细胞以TNF-α依赖的方式诱导MSCs产生免疫抑制MSC2表型。MSC2产生IL-6和COX-2的能力增强,从而诱导TAMs产生抗炎和促肿瘤M2表型。M2 TAMs和MSC2产生的免疫抑制细胞因子下调抗肿瘤免疫反应,使细胞不受控制的增殖。
此外,M2型 TAM生成的抗炎肿瘤微环境对MSC依赖性抑制肿瘤浸润的CD8+CTL至关重要。MSC2表达CD39和CD73外核苷酸酶,这些酶水解ATP和ADP,并在肿瘤微环境中产生高水平的腺苷。腺苷通过与腺苷特异性受体A2A结合,对CD8+CTL发挥免疫抑制作用。
除CTL外,CA-MSC还调节肿瘤浸润NK细胞的表型、功能和细胞毒性特性,并且诱导MDSCs和Treg的产生和扩增,从而减弱抗肿瘤免疫并支持肿瘤生长和进展。
在肿瘤微环境中,MSC不断暴露于肿瘤浸润性免疫细胞、内皮细胞和肿瘤细胞释放的生长因子和细胞因子。尽管大量研究证明了MSC的促肿瘤潜能,但必须注意的是,MSC不是组成性免疫抑制细胞。
事实上,在抗肿瘤免疫方面,MSC是一把双刃剑。作为可塑性细胞,MSC可能在其所暴露的生物因素的影响下具有不同表型和功能。MSCs可能获得促炎(MSC1)和抗炎(MSC2)表型,这取决于炎症细胞因子、TNF-α和IFN-γ的局部组织浓度。
当MSC植入低水平TNF-α和IFN-γ的组织时,它们获得促炎性MSC1表型,分泌大量炎症因子(IL-1β、IFN-α、IFN-β、TNF-α和IFN-γ),增强中性粒细胞和巨噬细胞的吞噬能力以及CTL和NK细胞的细胞毒性。相反,当MSC暴露于高水平的炎性细胞因子(TNF-α和IFN-γ)时,他们获得免疫抑制MSC2表型,其特征是抗炎因子(TGF-β、IL-10、PGE2、NO、IDO、IL-1Ra)的产生增加,这些因子抑制炎症免疫细胞的效应器功能并减轻持续的炎症。
与这些发现一致,观察发现外源性给药的MSC对肿瘤免疫和肿瘤进展的影响取决于它们在荷瘤动物中的接种时间。研究发现,在黑色素瘤生长的初始阶段移植的MSC具有肿瘤抑制作用,而在黑色素瘤发展的进展阶段注射的MSC抑制抗肿瘤免疫并增强肿瘤进展。由于在肿瘤诱导后24小时在荷瘤小鼠的血浆样本中检测到低水平的炎性细胞因子,并且这些炎性细胞因子的浓度在肿瘤进展过程中增加,可以想象在黑色素瘤发展的初始阶段注射的MSC因低炎性环境而获得抗肿瘤MSC1表型,而在黑色素瘤进展阶段由于炎性的增加,而获得免疫抑制和促瘤的MSC2表型。
MSC不表达MHC II类分子,因此可以移植到MHC不匹配的受者中。此外,MSC表达多种趋化因子受体,注射后迁移至肿瘤组织,参与抗肿瘤免疫反应。因此,一些临床研究评估了MSC的抗肿瘤特性。
由于其低免疫原性和肿瘤归巢特性,MSC被探索用作递送双特异性T细胞接合器的载体,从而实现特异性T细胞介导的肿瘤细胞消除。Szoor及其同事使用表达GPC3/CD3的双特异抗体的MSC,将GPC3/CD3 的T细胞接合器导向表达GPC3的癌细胞。GPC3+肿瘤细胞、表达GPC3/CD3的MSCs和T淋巴细胞的共培养导致GPC3特异性CD4+T细胞中IFN-γ的产生增加,GPC3特异性CTL的激活和扩增,从而产生对表达GPC3的恶性细胞的有效杀伤。在体内也观察到类似的发现,这些证明了MSCs在肝细胞癌免疫治疗中的治疗潜力。另一方面,低剂量紫外线辐射和X射线辐射在MSC中可以产生抗肿瘤MSC1表型,因此可用于MSC治疗。
此外,一些证据表明,MSC衍生的细胞外囊泡(MSC EV)含有MSC来源的抗肿瘤miRNAs,可以作为基于MSC的肿瘤免疫治疗的潜在治疗方法。由于脂质包膜,MSC EV容易绕过所有生物屏障,并将内容物直接输送到靶细胞。因此,MSC EV可以将MSC来源的抗肿瘤miRNA直接输送到肿瘤细胞中,从而改变其生存能力、增殖率和侵袭性特征。
由于MSC对肿瘤组织的高度亲和力以及对大多数化疗药物的耐药性增加,MSC已被探索作为抗癌药物的靶向递送剂。在接受含有抗癌药物紫杉醇(PTX)的MSC的荷黑色素瘤动物中发现肺转移数量减少。Layek及其同事证明了负载PTX的纳米和糖类工程MSC增强了抗小鼠卵巢癌的抗肿瘤特性。
作为载体,与其他药物相比,MSC具有许多优势。抗肿瘤药物负载的MSC直接在原发性和转移性肿瘤部位释放化疗药物,而不影响邻近组织。因此,与接受化疗治疗的荷瘤动物相比,接受载药MSC的实验动物的副作用减少,半衰期延长,抗肿瘤效果更好。
MSC作为一种可塑性细胞,根据邻近肿瘤浸润免疫细胞的细胞因子决定其表型和功能。在抗肿瘤免疫方面,表现出双面特性。
然而,由于其低免疫原性和肿瘤归巢特性,其在抗肿瘤免疫方面表现出一定的应用潜力。表达双特异性T细胞结合器以及产生抗肿瘤性miRNA的基因工程MSC可作为肿瘤免疫治疗的新疗法。随着对MSC在抗肿瘤免疫方面的认识进一步加深,期待MSC可以在治疗癌症的应用方面发挥更大的作用。
