


胃癌在癌症相关死亡率中排名第三,被认为是全世界最难治愈的癌症之一。在晚期或转移性胃癌或胃食管交界处(GEJ)腺癌患者中,中位总生存期(mOS)不超过10个月。虽然人类表皮生长因子受体2(HER-2)靶向治疗和免疫检查点抑制剂已经为特定人群带来福音,但在进展期胃癌中寻找其他靶点势在必行,claudin18.2(CLDN18.2)随之而来。
Claudins是一个蛋白质家族,其作用是维持控制细胞间分子交换的紧密连接。广泛分布于胃、胰腺和肺组织,可用于诊断和治疗。CLDN18.2亚型是一种胃特异性亚型,自从Sahin发现CLDN18.2是一种高度选择性的分子,并且只在癌细胞中广泛表达,它就成为一种理想的靶点。CLDN18.2通常埋藏在胃粘膜中,正常组织中的单克隆抗体基本上接触不到,恶性肿瘤的发生会导致紧密连接的破坏,使肿瘤细胞表面的CLDN18.2表位暴露出来,成为特定的靶点。因此,CLDN18.2赋予靶向治疗的特异性。最近发现在胰腺癌(50%)、食管癌和肺癌中的表达也显示了诊断和治疗其他肿瘤的潜力。
Claudins是一个组成紧密连接(TJs)的完整膜蛋白家族,TJs是主要的细胞间连接,充当通透性屏障,通过划分膜上下区域赋予上皮细胞极性。目前,哺乳动物claudin家族由27种蛋白质组成,许多选择性剪接claudin蛋白在各种组织中表达。
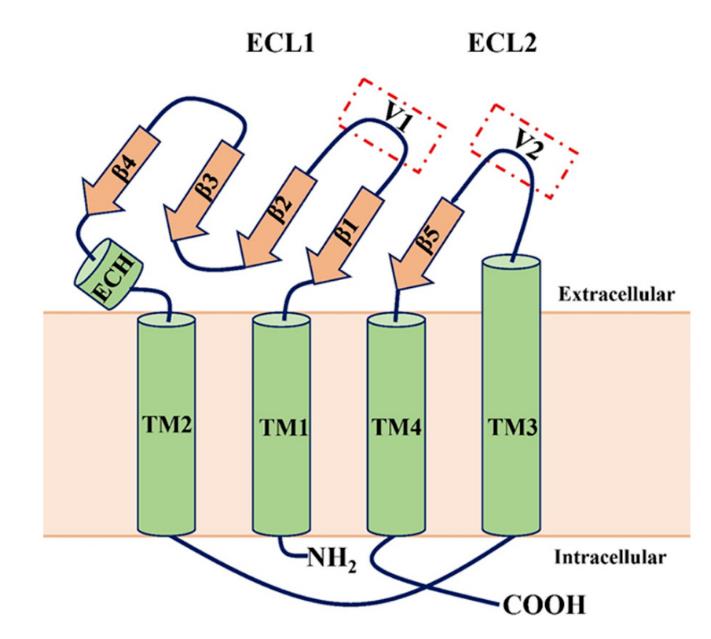
Claudins是四次跨膜蛋白,包括四个跨膜结构域(TM1-4)、细胞内N端和C末端以及两个细胞外环(ECL1和ECL2)。ECL1包含四条β链和一条胞外螺旋(ECH),ECL2包含一条β链和一个细胞表面暴露的部分跨膜结构域。
ECL参与claudin链之间相互作用的形成,并通过两个可变区域形成基于claudin的闸门功能。根据生理学研究,提出了两种闸门功能机制:“孔隙”机制,其中溶质或离子通过由TJ链形成的细胞旁通道,以及“泄漏”机制,溶质可能通过TJ链中的断裂。此外,通过与许多其他信号分子的相互作用,claudin主要作为抑制因子发挥作用,从而影响细胞生长、存活、增殖和分化。
Zolbetuximab(IMAB362,claudixmab)是第一种针对该靶点的开发药物,是一种嵌合的IgG1单克隆抗体,在肿瘤细胞表面与CLDN18.2特异结合,从而引发抗体依赖性细胞毒性(ADCC)、补体依赖性细胞毒性(CDC),凋亡和抑制细胞增殖。临床前研究已经成功地证实了它具有清除癌细胞和控制疾病的强大能力。随后,通过多个I/II期试验评估了其临床疗效和安全性。
第一项人体临床试验(NCT00909025)旨在确定剂量递增队列中Zolbetuximab的最大耐受剂量和推荐剂量,15名先前接受过治疗的进展期胃腺癌/GEJ腺癌患者进入评估。最后评估使用600 mg/m2的剂量为后续的推荐研究剂量。
IIa期临床试验(NCT01197885,MONO 2013)研究了其对54例难治性晚期或转移性CLDN18.2阳性胃腺癌患者的疗效和安全性。筛选病人为CLDN18.2阳性和东方肿瘤合作组(ECOG)表现为0-1的患者。值得注意的是,阳性率定义为在>50%的肿瘤细胞中CLDN18.2染色强度≥2+。研究结果显示,中位无进展生存期(mPFS)提高到14.5周,受试者的平均响应时间延长至24.6周(范围13.1-156.1周)。10例患者获得临床改善,其中PR 4例(9%),SD 6例(14%),其中90%的患者CLDN18.2高表达。44名患者(82%)出现治疗相关不良事件(TRAEs),其中大多数为1级或2级。在超过10%的人群中,恶心、呕吐、疲劳和食欲减退是与Zolbetuximab相关的主要事件。所有严重TRAEs均出现在接受600mg/m2剂量的患者中。这些问题可以通过暂停或减缓注射Zolbetuximab来解决。此外,在MONO研究中,54%的患者接受过胃切除术。未行胃切除术的病人更容易出现恶心和呕吐。反复输注Zolbetuximab可降低发病率。
另外一项I期试验(NCT01671774,PILOT 2014)研究了Zolbetuximab联合唑来膦酸和白细胞介素-2对CLDN18.2阳性胃食管腺癌的化疗难治性患者的安全性。观察mOS为40周,mPFS为12.7周。TRAEs包括恶心和呕吐,主要为1-3级,无不良事件导致研究中止。15例患者中有13例经历了1次以上的TRAEs,其中胃肠道疾病最为常见。
一项IIb期研究(NCT01630083,FAST 2015)评估了Zolbetuximab与一线表柔比星、奥沙利铂和卡培他滨(EOX)化疗对晚期/复发性胃癌/GEJ患者的疗效。如果肿瘤表达CLDN18.2,而没有HER-2,则符合条件。纳入标准还包括0−1的ECOG状态。FAST研究显示,实验组和对照组的mPFS分别为7.5个月和5.3个月(危险比(HR)=0.44;95% CI:0.29,0.67)。Zolbetuximab联合EOX组的OS获益为13.2个月,而单用EOX组为8.4个月(HR=0.56;95% CI:0.40,0.79),客观缓解率(ORR)更高(39%对25%;P=0.022)。其中CR 8例(10.4%),PR 22例(28.6%),SD 34例(44.2%)。对照组PR、CR和SD分别为18例(21.4%)、3例(3.6%)和43例(51.2%)。
另外一项探索性分析表明,Zolbetuximab与EOX联合治疗相比EOX单药,CLDN18.2高表达(在≥70%肿瘤细胞中强度≥2+)的患者预后良好(PFS,9.1个月vs.6.1个月;HR=0.46;OS,16.6vs.9.3个月;HR=0.44)。呕吐是EOX+zolbetuximab组最常见的毒性反应(1/2级呕吐率分别为55.8%和34.0%,3/4级呕吐率分别为10.4%和3.0%)。呕吐的发生率和严重程度与Zolbetuximab呈剂量依赖关系。
Claudin 18.2作为极具前景的肿瘤靶向治疗靶点,众多创新药企争相布局,成为必争之靶点高地。目前为止,国际国内20多家药企布局了claudin 18.2靶向药物的临床开发,大部分在研项目属于单靶点抗体药物,包括claudin 18.2双抗药物、ADC和CAR-T也迎来振奋人心的新进展。
2020年7月1日,国家药品监督管理局药品审批中心(CDE)受理Amgen/百济神州的AMG 910临床试验申请。AMG 910是一款CD3/Claudin 18.2双特异性抗体。目前处于I期临床,主要目的是评价AMG910在claudin18.2阳性的胃癌或胃食管交界处癌成人受试者中的安全性和耐受性。
2021年10月4日,再鼎医药在Clinicaltrails.gov网站登记了Claudin 18.2抗体ZL-1211的美国1/2期临床,计划入组162例晚期实体瘤患者;
已有的临床结果表明,Zolbetuximab治疗胃癌具有显著的疗效和安全性。尽管大量的研究结果不断涌现,但靶向CLDN18.2在许多研究中的不同结果可能反映了测试群体的局限性,以及使用的界限值的差异。在接下来的部分中,我们将集中讨论最近人们关注的10个问题,以期找到CLDN18.2治疗的未来方向。
1. 是否有统一的检测手段?
应使用高度特异性的试剂来区分CLDN18.2和剪接变体(claudin 18.1)。CLAUDETECTTM18.2试剂盒(由Ganymed开发,现由Astellas获得)是一种半定量免疫组织化学试验,首次用于人体研究和FAST研究。而MONO试验是用抗CLDN18.2兔抗血清(Zymed)鉴定样本。这可能部分解释了这些试验中不同的阳性阈值和疗效。这里提倡使用统一的检测手段来鉴别CLDN18.2。
2. 人口流行特征是什么?
CLDN18.2阳性群体的大量分布为其广泛应用奠定了基础。FAST试验和MONO试验分别显示了白人群体48%和45%的客观分布。36%和24%的患者出现高表达水平。在其他试验中,一些调查补充了CLDN18.2阳性患者的患病率。在日本的一项研究中,52%(135/262)的原发性肿瘤呈阳性(FAST的标准),这支持了在亚洲人中使用Zolbetuximab的治疗评估。进一步的研究表明,高CLDN18.2在美国样本中达到34%,在亚洲样本中达到24%。亚裔还是高加索人群体更符合条件还有待探索。HER-2总阳性率为10%,这表明,与HER-2的患病率(16.6%)相比,Zolbetuximab可使更多的人群受益。在FAST研究中,只有14%的CLDN18.2阳性患者同时表达HER-2,这表明CLDN18.2可以作为一个新的胃癌亚群的非重叠靶点。
3. CLDN 18.2作为预后的评判价值有多少?
与HER-2相似,CLDN18.2是否可以作为有意义的预后评判指标,以及与这一点相关的直接证据尚不清楚。首先,CLDN18.2表达水平是否与Lauren亚型以及癌症基因组图谱(TCGA)和亚洲癌症研究小组(ACRG)的分子亚型相关存在争议。另外,CLDN18.2的相关性在弥漫型还是在肠道亚型中更高,或有无显著性差异是有争议的。然而,在一个高加索人群的研究(n=481)中,CLDN18.2的表达水平与Lauren亚型之间没有显著的相关性,而高表达的CLDN18.2与EBV状态、TCGA分子亚型相关。另一种组织微阵列分析(n=523)证实了这一点,其中CLDN18.2阳性与EBV相关癌症和弥漫型相关。其次,基因改变值得我们关注。近年来,CLDN18-ARHGAP26/6融合在伴有淋巴结转移和远处转移的弥漫型胃癌中普遍存在,显示以奥沙利铂/氟嘧啶为基础的化疗无效。因此,融合状态可作为有效性的有效反应预测因子。组织学样本显示,浸润前沿的claudin18与增殖潜能呈负相关。有必要进一步分析以确定其预后价值。
4. 是否需要新的界限值?
值得注意的是,CLDN18.2水平的界限值在不同的试验中有所不同。首先,MONO试验和FAST试验之间存在PFS差异(14.5周vs.7.5个月),这可能与患者状态和不同的界限值(由不同的测试试剂引起)有关。其次,相对于中等水平,对高表达水平的CLDN18.2(≥75%肿瘤细胞中强度≥2+)进行亚组分析,总有更好的疗效(16.6个月vs.9.3个月)。然而,在MONO研究中,≥70%肿瘤细胞中≥2+CLDN18.2的患者获得相同的ORR。III期试验(NCT03505320)的灵感就是为了进一步证实这一点,使患者获得与FAST试验一样高的水平。进一步的研究,调查CLDN18.2表达的最佳界限值是有必要的。不同的检测试剂和患者群体(种族)是否需要唯一的界限值也需要进一步的探索。
5. Zolbetuximab是否有资格成为第二位的靶向候选药物(与HER-2相比)?
毫无疑问,Zolbetuximab在HER-2阳性进展期胃癌患者的靶向治疗中处于领先地位。EOX+zolbetuximab治疗效果最好(13.2个月),可与ToGA(13.3个月)相比较,显示其更大的潜力,成为胃癌的第二个有希望的靶点。CLDN18.2高表达亚组(16.6个月)的mOS甚至优于ToGA(13.8个月)。与Trastuzumab相似,恶心和呕吐是最常见和最严重的不良反应。到目前为止,还没有观察到与Zolbetuximab相关的治疗耐药性。尽管在FAST研究中CLDN18.2和HER-2共表达显示对Zolbetuximab有效,但针对CLDN18.2阳性/HER-2阳性以及CLDN18.2阳性/HER-2阴性患者的试验仍在进行中。
6. 联合治疗会取得更好的效果吗?
目前,临床热点主要集中在靶向药物与化疗/免疫治疗的协同作用上。虽然目前尚无联合免疫治疗的报道,但靶向CLDN18.2理论上可促进T细胞浸润和抗原递呈,从而提高免疫检查点抑制剂的疗效。像bevacizumab这样的抗血管生成药物可以启动参与ADCC的IgG下游效应器,从而帮助Zolbetuximab发挥作用。化疗不仅可以增强Zolbetuximab诱导的ADCC,而且可以直接诱导癌细胞凋亡。此外,化疗通过增加CLDN18.2的表达使肿瘤细胞对Zolbetuximab更敏感,随后诱导促炎性细胞因子。临床前和临床资料均表明,化疗方案可帮助Zolbetuximab提高对CLDN18.2阳性进展期胃癌患者的生存率。
2018年,一项在高加索人种中的II期试验(NCT03505320)对HER-2阴性/CLDN18.2阳性的不可切除胃癌/GEJ癌症应用Zolbetuximab+mFOLFOX进行了评估。除有效性和安全性外,还将评估Zolbetuximab的药代动力学和免疫原性。接下来将进行一项III期试验(NCT03504397),将在更大的人群中调查Zolbetuximab+mFOLFOX的联合疗效。另一种一线治疗选择CAPOX也将在III期试验(NCT03653507)中与Zolbetuximab联合,以验证其疗效。
然而,考虑到东西方人群的差异,三种药物联合使用所增加的毒性大于疗效,这在亚洲人身上很难复制。为了在保持疗效的同时避免不耐受,顺铂+氟尿嘧啶(S-1)作为一线治疗方法有望与Zolbetuximab联合应用。亚洲人群中CLDN18.2阳性患者值得更多考量。
7. 有没有其他的靶向剂?
其他具有高选择性和亲和力的分子,如GB7004-09hu15和IMAB362-VCME,具有很强的抗肿瘤作用,但毒性较小。他们证明了抗体偶联药物在CLDN18.2靶点上的应用,也为临床探索提供了新的思路。此外,利用高选择性分化抗原的CLDN18.2特异性表位作为抗原载体进行免疫接种,可产生杀瘤潜力并抑制转移。
8. CAR-T细胞治疗胃癌有效吗?
由于CLDN18.2的高特异性有助于T细胞识别肿瘤,因此被用于嵌合抗原受体T(CAR-T)细胞治疗。尽管CAR-T细胞治疗在实体瘤中曾遭遇挫折,但由于与标准疗法相比,PDX模型可验证体内疗效,因此可能会取得突破性进展,证明CLDN18.2特异性CAR-T细胞可作为其他潜在CLDN18.2阳性肿瘤的有前途的治疗策略,特别是胃癌。
正在进行的I期研究(NCT03159819)探讨了CLDN18.2特异性CAR-T细胞的临床应用,包括安全性、耐受性和细胞动力学。针对12例CLDN18.2阳性实体瘤患者,其中胃癌7例。在11名可评估的受试者中,1名获得CR(胃癌),3名患PR(包括2名胃癌),5名患者获得SD,2名患者疾病进展。胃癌的ORR为42.8%(3/7),总ORR达33.3%,mPFS为130天。
9. 胃癌中CAR-T细胞治疗安全吗?
尽管CAR-T细胞治疗因其毒性如细胞因子风暴而具有挑战性,但临床前研究和正在进行的试验缓解了这种担忧。Jiang等人将T细胞与抗原结合元件hu8E5−2I结合,构建了CLDN18.2 CAR-T细胞,表明它不仅赋予CAR-T细胞强大的清除小鼠CLDN18.2阳性细胞的能力,而且对PDX模型正常组织无明显毒性。I期试验报告没有严重的胃毒性或细胞因子释放综合征(CRS),除了淋巴细胞和中性粒细胞减少外,没有观察到4级不良事件。轻微的靶向非肿瘤效应可能与独特的肿瘤微环境有关。
10. 如何改进CAR-T细胞治疗?
在PDX模型中,CD3和CLDN18.2的双特异性T细胞接合器(BiTEs)被设计成具有两个结合位点。因此,BiTEs可通过结合其CD3和靶向CLDN18.2来引导T细胞,从而改善ADCC,且毒性小。这种疗法被证明优于传统疗法。CLDN18.2的新型四价双特异性(TetraBi)抗体显示出令人印象深刻的抗肿瘤活性,提供了比双特异性形式更好的疗效。在临床前研究中,尽管BiTEs在PDX模型上取得了成功,但原位模型的效果和安全性是否会保持乐观仍不确定。虽然没有显著的不良事件报告,但发生了1级或2级的CAR-T细胞治疗特异性CRS,提示细胞因子风暴可能在理论上挑战临床应用。接下来,一些正在进行的I期试验正在探索CLDN18.2 CAR-T细胞治疗在更大规模人群中的治疗浓度和安全性,包括剂量限制毒性和最大耐受剂量(NCT03874897,NCT03890198)。它们将提供疗效的证据。
首先,CLDN18.2可能是继HER-2之后胃癌的第二重要靶点。在高表达的人群,它甚至超过了HER-2。FAST试验中OS的疗效不亚于HER-2。需要进一步研究以确定CLDN18.2水平的理想界限值,以获得最佳效益。
第二,联合治疗是值得期待的。随着Zolbetuximab联合化疗方案的兴起,与其他靶向药物联合治疗可能也值得研究。值得注意的是,联合应用Zolbetuximab和免疫治疗可刺激T细胞浸润,这与免疫检查点抑制剂相协调。
最后,更多的预测预后的意义需要进一步的调查。分子亚型在指导精确的药物治疗方面具有更大的潜力,如CLDN18-ARHGAP26/6融合,表明生存率和化疗抵抗力较差。更多的CLDN18.2的预测因子可以被探索和验证,从而使特殊人群受益。
CLDN18.2在HER-2阴性胃癌患者中是一个很有前途的靶点,不仅选择性高,而且在人群患病率方面也很有潜力,是胃癌靶向治疗的理想补充。新型抗体zolbtuximab,无论是单药治疗还是联合化疗,都显示出显著的优越疗效和安全性。CLDN18.2CAR-T细胞治疗最近以其优异的表现探索了另一种可能性。该策略将进展到第三阶段临床试验,当与其他疗法相结合时,将可能进一步的提升疗效。随着分子结构和临床试验的不断完善,抗CLDN18.2治疗将完美地回答各种疑问,并在未来带来更多惊喜。
参考文献:
1. Evaluation and reflection on claudin 18.2 targeting therapy in advanced gastric cancer. Chin J Cancer Res. 2020 Apr; 32(2): 263–270.
2. clinicaltrials.gov
3. 各公司官网
疫苗得到了极速发展,成为目前研究的热门领域之一。mRNA疫苗已经在针对SARS-CoV-2的保护中展现出卓越的效果,并且在治疗不同类型的恶性肿瘤和其它传染病方面也显现出潜在疗效。
然而,针对mRNA疫苗的安全性人们还有很多疑惑,目前,mRNA疫苗也只有在SARS-CoV-2的预防中获得批准,其在其它方面的疗效还有待进一步研究。很多问题需要解决,下面我们来一起探讨未来mRNA疫苗可能会面临的一些关键问题。
接种疫苗后,抗原被抗原呈递细胞吸收并运输到淋巴结,在淋巴结中,B细胞、抗原呈递细胞和滤泡辅助性T细胞(Tfh)之间的相互作用促进生发中心的形成。在生发中心内,B细胞随后增殖、分化并突变其抗体基因,以产生针对攻击性抗原的高亲和力中和抗体。生发中心反应和Tfh细胞诱导对于持久的抗体反应至关重要,这将保护患者数月或数年。
为了增强这一免疫反应过程的第一步,一些传递系统以抗原呈递细胞为靶点,翻译mRNA。积极靶向抗原呈递细胞的几种有希望的策略包括将单克隆抗体与LNP表面结合,并用树突状细胞特异性配体修饰LNP表面。或者,调节LNP的物理性质,如表面电荷,已用于提高癌症疫苗疗效。
此外,通过延长抗原mRNA的翻译来改变疫苗药代动力学已成为增强抗体反应的令人兴奋的工具。生发中心反应期间持续的抗原可用性已被证明可使抗体产生量增加约10倍。在小鼠中的一项研究表明,与未经修饰的mRNA相比,核苷修饰的mRNA循环时间更长,并诱导更强的Tfh细胞和生发中心B细胞反应。
在临床试验中,两次剂量的mRNA-1273也能在6个月内引发持久的抗体反应。尽管抗体滴度在研究期间略有下降,但所有年龄组均保持较高的中和能力。这些结果是有希望的,然而,抗体反应的持续时间是一个复杂的现象,不同的抗原会有所不同,需要更长期的数据才能全面理解。
病毒基因组的突变在复制过程中很常见。尽管大多数突变对病毒的功能影响很小或没有影响,但一些突变可以增强免疫逃避,阻碍疫苗的开发。例如,30多年来,艾滋病毒的快速突变阻碍了有效疫苗的开发,而流感病毒的突变需要每年对疫苗配方进行修改,以针对优势毒株。
新出现的SARS-CoV-2变异也引起了对mRNA疫苗交叉变异效力的关注。B.1.351和P.1变体在棘突蛋白受体结合域的484位(E484K)存在谷氨酸(E)到赖氨酸(K)突变,这促进了免疫逃避。幸运的是,FDA批准的mRNA疫苗BNT162b2和mRNA-1273产生了针对B.1.351和P.1以及其他变体的交叉中和抗体,这表明它们可以提供针对它们的保护。然而,与最先的病毒相比,交叉中和效应已经显著降低。此外,在CureVac的候选CVnCoV的IIb/III期试验中,测序的124个COVID-19病例中有57%都是突变体,包括B.1.351和P.1变体。
如果这些变异毒株随时间逐渐成为主要变异体,则可能需要变异体特异mRNA增强剂。目前,Moderna正在评估最初的mRNA-1273疫苗和作为第三剂增强剂的最新版疫苗:mRNA-1273.351,它编码来自B.1.351变体的棘突蛋白,以及mRNA-1273.211,一种mRNA-1273和mRNA-1273.351的1:1的混合疫苗。
从长远来看,提供SARS-CoV-2和未来冠状病毒爆发保护的泛冠状病毒疫苗将会更有利。与HIV和流感一样,新的结构洞察有望促进冠状病毒保守位点的发现,加速抗原发现和疫苗设计。
总的来说,mRNA疫苗具有良好的安全性,临床试验中仅发生轻度或中度不良事件。然而,也有个别事件要求进一步优化mRNA抗原和运载工具组件。例如,CureVac基于鱼精蛋白的狂犬病候选药物CV7201在78%的参与者中引发严重不良事件,促使CureVac采用LNPs作为其后续狂犬病候选药物CV7202的首选给药平台。
与大多数药物一样,mRNA疫苗的不良反应往往随着剂量的增加而增加。例如,在CV7202的第一阶段试验中,5μg剂量具有不可接受的毒性,而1μg是耐受性良好的最高剂量。此外,在Moderna H10N8流感疫苗的第一阶段试验中,在400ug剂量患者出现严重不良事件,因此,试验以100μg剂量继续。
在使用Pfizer–BioNTech和Moderna的COVID-19疫苗时,分别在约百万分之4.7和百万分之2.5的接种者中观察到过敏反应,这大约是传统疫苗接种的2-4倍。一种说法认为,过敏反应归因于人群中预先存在的针对LNP中聚乙二醇化脂质的抗体。这些抗体被认为对许多消费品(例如牙膏、洗发水和泻药)中的PEG存在反应。据报道,40%的人群中存在抗PEG抗体,这可能会增加某些个体发生过敏反应的风险,并阻碍疫苗的效力。目前,CDC建议,对于对Pfizer–BioNTech或Moderna疫苗的任何成分有过敏史的个人,不应使用mRNA疫苗。很明显,我们需要更好地理解mRNA疫苗配方是如何引起过敏反应的,以便可以重新设计配方以改善安全性。
大多数疫苗,无论是传统疫苗还是mRNA疫苗,都是针对儿童或健康成人开发的。然而,由于免疫系统的不同,一些人群可能受益于替代疫苗接种策略或对疫苗接种的反应不同。
产妇/新生儿疫苗接种
怀孕期间免疫系统的动态特性增加了一个人对传染病的易感性,而感染会对产妇健康和胎儿发育造成灾难性影响。
为了应对这些挑战,产妇疫苗接种已成为改善产妇健康和降低新生儿发病率的工具。母体IgG抗体通过与新生儿Fc受体结合,很容易穿过胎盘,进入胎儿循环,保护胎儿免受病原体的侵害。在几项研究中,母亲接种mRNA负载的LNPs可防止怀孕小鼠中的胎儿寨卡病毒传播,并保护新生小鼠免受疱疹病毒和链球菌的感染。
尽管垂直转移的母体抗体可以防止新生儿感染,但它们也会阻碍对婴儿在以后的生活中接种疫苗的效果,其机制尚不清楚。延长抗原的可用性可能促进更强烈的生发中心反应,从而在存在母体抗体的情况下产生强大的婴儿免疫反应。
抗SARS-CoV-2的mRNA疫苗也被证明对怀孕和哺乳期人群具有免疫原性,并且在脐血和人类乳汁中检测到中和抗体。初步数据表明,mRNA-1273和BNT162b2在怀孕和非怀孕人群中引发类似的不良事件,并且疫苗不会增加新生儿死亡或先天性异常的发生率。然而,需要进一步的纵向研究来评估mRNA疫苗对产妇和新生儿健康的影响。
老年人
这一群体急需有效的疫苗,因为许多传染病影响着老年人。例如,70至90%的流感相关死亡率发生在65岁以上的患者中,而COVID-19的死亡率在大于65岁的患者中是年轻患者的62倍。
老年人更难接种疫苗,因为老龄化对免疫系统的先天和适应性反应都有不利影响。Toll样受体表达减少会阻止单核细胞和巨噬细胞分泌细胞因子和趋化因子,并限制与适应性免疫系统的串扰。由于细胞因子信号受损以及生理和细胞变化,感染期间的适应性免疫反应通常不充分。这些变化包括胸腺退化、幼稚B细胞和T细胞减少、T细胞受体多样性减少、对T细胞凋亡的更高易感性以及细胞毒性CD8+T细胞上关键受体如CD28的表达减少。
幸运的是,越来越多的证据表明,mRNA疫苗可能在所有年龄组都具有强大的效力。例如,在III期试验中,Pfizer–BioNTech的候选疫苗BNT162b2在所有治疗组中的疗效均超过93%。Moderna候选疫苗mRNA-1273也非常有效,在≥65岁的志愿者中显示出86.4%的有效性,相比之下,18-65岁志愿者的疗效为95.6%。
运载工具的设计对于提高老年人的疫苗效力非常重要。mRNA载体可以作为炎症佐剂,通过增强抗原提呈细胞向注射部位的募集来放大疫苗反应。在一项临床前研究中,CureVac的RNAVAC激活了TLR7,并在小鼠中产生了针对致命流感的持久免疫应答。诺华公司的乳剂MF59已经被用作mRNA递送载体,也可以作为佐剂。MF59增强了流感疫苗的免疫原性,已被批准用于老年人。
获得疫苗是实现广泛预防传染病的最大挑战,特别是在低收入国家。目前批准的SARS-CoV-2 mRNA疫苗的冷藏要求进一步限制了疫苗的获取。便携式和可重复使用的Arktek冷冻柜可以在流行病期间实现数百万剂疫苗的快速部署。
然而,在COVID-19病毒需要接种数十亿人,这需要耐热疫苗。目前,有两种SARS-CoV-2候选疫苗在室温下具有耐热性,如果这些耐热候选疫苗在临床试验中能够显示出良好的结果,他们可能在不久的将来简化全球对mRNA疫苗的获取。
疫苗只有在接种后才有效,支持疫苗安全性和有效性的数据非常丰富,疫苗已经在世界部分地区根除了几种传染病,挽救了无数人的生命。然而,由于错误信息和反疫苗运动,公众的不信任感加剧,威胁到群体免疫力的维持,并使我们最脆弱的人群处于危险之中。
疫苗接种覆盖率下降可能导致威胁生命的疾病再次出现。例如,2000年从美国根除的麻疹在2019年感染了1200多人,原因是多个社区的疫苗依从性差。对于COVID-19,在美国,目前56–75%的接受度可能不足以达到至少80–90%的覆盖率,这一阈值被认为是对SARS-CoV-2群体免疫所必需的。
尽管提高疫苗覆盖率的大部分负担落在政府和公共卫生官员身上,科学界也可以通过提高mRNA疫苗的效力和安全性来提供帮助。提高疗效将降低群体免疫所需的接受度,提高安全性将阻止媒体对不良事件的报道,从而减少对疫苗接种的恐惧。
几十年来,mRNA设计和核酸递送技术的进步,加上新抗原靶点的发现,使得mRNA疫苗成为对抗新兴流行病和现有传染病的非凡工具。两种针对SARS-CoV-2的mRNA疫苗,以革命性的速度研制,并提供了卓越的保护率,有望结束COVID-19的大流行。
此外,这些疫苗将LNP和RNA治疗从小众市场的产品提升为在大量人群中成功实施的预防性治疗。由此产生大量的安全性和有效性数据,以及成功的监管部门批准。我们可以乐观地认为,mRNA疗法将可能改变现代医学的疫苗接种方法、癌症免疫疗法以及蛋白质替代疗法。
