创新药IND有望实现30日完成审批
2024-08-14 09:34:30
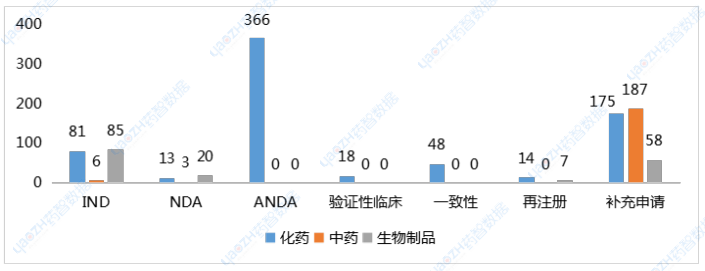
药智数据显示,7月CDE共受理新的药品注册申请以品种统计(按药品+企业维度)1219个(受理号1698个),是全年迄今申报品种最多的月份。完成审批方面,7月CDE完成审批920个品种(受理号1268个),其中化药577个品种,中药209个品种,生物制品134个品种。值得一提的是,近日国家药监局提出优化创新药临床试验审评审批机制,实现30个工作日内完成创新药临床试验申请的审评审批,目前已同意在北京、上海两地开展试点,全面支持创新药高质量发展。7月,CDE共受理新的药品注册申请以品种统计(按药品+企业维度)1219个(受理号1698个),是全年迄今申报品种最多的月份。其中化药802个品种,中药243个品种,生物制品174个品种;申请类型为新药、进口、仿制的注册申请共计591个品种。以注册申请审评任务类型统计,受理新药临床试验申请(以下简称IND)172个品种;新药上市许可申请(以下简称NDA)36个品种;同名同方药、仿制药、生物类似药上市许可申请(以下简称ANDA)366个品种);仿制药质量和疗效一致性评价注册申请(该注册申请类别以下简称一致性评价申请)48个品种。
PS:药智网公众号【ID:yaozh008】后台回复【药审7月】,即可获取本文表格excel格式文档

 1类创新药受理136个品种(受理号206个),以注册申请审评任务分类统计,IND申请128个品种,其中国产品种107个、进口品种21个;NDA申请8个品种,国产品种7个、进口品种1个。2类改良型新药注册申请受理47个品种(受理号79个),以药品类型分类统计,改良型中药申请3个品种,改良型化学药申请25个品种,改良型生物制品申请19个品种。创新药及改良型新药申报地区,依旧集中于上海、江苏、北京三地;剂型以注射液为主,其次为片剂、粉针。申报品种数最多的企业分别正大天晴药业集团南京顺欣制药有限公司、苏州盛迪亚生物医药有限公司、默沙东、齐鲁制药有限公司,均以申报3个品种并列第一。表1 7月创新药与改良型新药注册申请受理情况(单位:个)
1类创新药受理136个品种(受理号206个),以注册申请审评任务分类统计,IND申请128个品种,其中国产品种107个、进口品种21个;NDA申请8个品种,国产品种7个、进口品种1个。2类改良型新药注册申请受理47个品种(受理号79个),以药品类型分类统计,改良型中药申请3个品种,改良型化学药申请25个品种,改良型生物制品申请19个品种。创新药及改良型新药申报地区,依旧集中于上海、江苏、北京三地;剂型以注射液为主,其次为片剂、粉针。申报品种数最多的企业分别正大天晴药业集团南京顺欣制药有限公司、苏州盛迪亚生物医药有限公司、默沙东、齐鲁制药有限公司,均以申报3个品种并列第一。表1 7月创新药与改良型新药注册申请受理情况(单位:个)

7月,CDE完成审批920个品种(受理号1268个),其中化药577个品种,中药209个品种,生物制品134个品种。按药智审评结论统计,批准临床214个品种,批准生产186个品种,批准进口13个品种,未被批准61个品种。创新性新药及改良型新药共计完成审批156个品种,其上市批准率约为57%。1类创新药完成审批115个品种,批准临床品种114个,另一上市申请未被批准。2类改良型新药完成审批41个品种,IND申请35个品种,均已批准临床;NDA申请6个品种,2个品种未被批准。表2 7月境外原研、创新及改良型新药上市申请审评结论情况
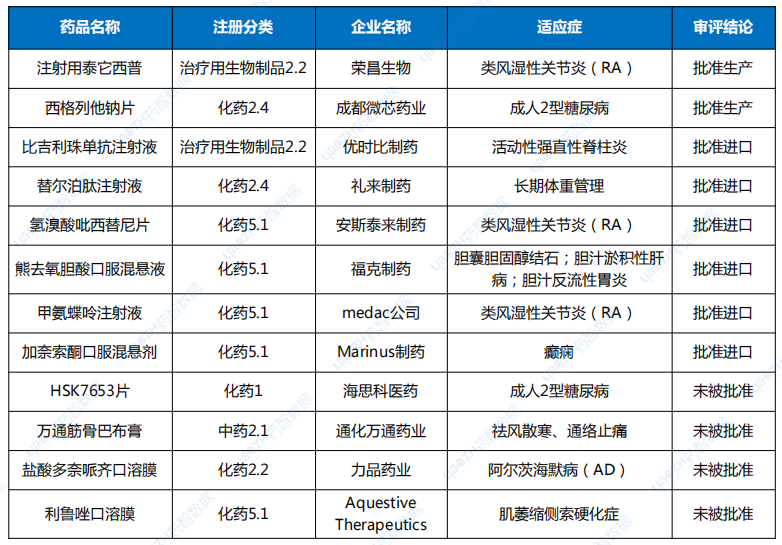
7月,CDE共将2个品种纳入了优先审评名单,分别是雅培制药的匹维溴铵片,按“其他优先审评审批的情形”理由纳入优先审评;其次是上海信致医药的BBM-H901注射液,用于治疗血友病B(先天性凝血因子Ⅸ缺乏症)成年患者,纳入优先审评理由为“临床急需的短缺药品、防治重大传染病和罕见病等疾病的创新药和改良型新药”和“纳入突破性治疗药物程序”。突破性治疗品种名单也仅有4个品种入选,分别是治疗慢性乙肝的AHB-137注射液;适用于治疗RPE65双等位基因突变相关的遗传性视网膜营养不良(IRD)的LX101注射液;用于治疗组织基因型为HLA-A*02:01,肿瘤抗原NY-ESO-1表达为阳性的软组织肉瘤的TAEST16001注射液;局部晚期或转移性非小细胞肺癌(仅限非耐药性罕见EGFR突变,包括L861Q、G719X和/或S768I)的马来酸苏特替尼胶囊。







