在变革B细胞恶性肿瘤治疗之后,CAR-T这辆“小车”又马不停蹄地向自免阵地驶去。
B细胞靶向CD19 CAR-T细胞疗法在系统性红斑狼疮(SLE)等自身免疫性疾病中的应用已经取得了令人信服的早期结果。以2024年为例:
- 2月21日,德国埃尔朗根-纽伦堡大学的GeorgSchett教授团队在NEJM杂志上报道了15例自身免疫性疾病患者(8例SLE、4例系统性硬化症和3例特发性炎性肌病)在接受CAR-T细胞疗法后重获新生,患者不再出现症状或不再需要进行新的治疗,其中第一批接受治疗的患者已经保持了两年多无病状态。
- 7月15日,海军军医大学长征医院/清华大学医学院徐沪济教授联合邦耀生物等合作伙伴在Cell杂志发表了通用型CD19 CAR-T细胞治疗3例难治性自身免疫性疾病患者的病例报道,其中1例为免疫介导的坏死性肌炎(IMNM)、2例为系统性硬化症(SSc)。结果表明,通用型CD19 CAR-T细胞在所有患者体内能够有效扩增和完全清除B淋巴细胞,3个月后实现B细胞的重塑。IMNM患者肌力显著改善,肌肉炎症明显缓解,自身抗体完全清除。SSc患者的皮肤软化,心肺等重要器官的纤维化也明显改善,且在6个月随访时持续改善。这是国际上首次报道异体通用型CAR-T治疗自身免疫性疾病。
- 7月24日,来自北京协和医院的研究团队在NEJM杂志报道了全球首次利用CD19 CAR-T治疗系统性红斑狼疮相关免疫性血小板减少症的病例:回输后CAR-T细胞在患者体内扩增良好,回输第28天血液中CD19阳性B细胞被清除,第三个月时B细胞重建。血小板计数治疗后的6个月内持续上升,达到临床完全缓解,且患者停用了糖皮质激素和所有免疫抑制剂。
除了发表在顶级期刊上的结果,CAR-T治疗自身免疫性疾病的代表性公司Kyverna Therapeutics今年3月29日也在Med上发表了利用CD19 CAR-T(KYV-101)首次治疗两例进行性多发性硬化症(MS,一种慢性神经退行性自身免疫性疾病)患者的积极研究结果。研究发现KYV-101在两例患者中均显示了可接受的安全性,尽管在脑脊液中检测到CD19CAR-T细胞,但未观察到免疫效应细胞相关神经毒性综合征(ICANS);此外,在病例1中,CAR-T细胞输注后脑脊液中鞘内抗体的产生显著减少,并持续到第64天。这些结果支持进行更大规模的临床研究来评估CAR-T疗法治疗MS的潜力。接连不断的临床喜讯使得CAR-T在自免疾病领域的研发愈发火热,近几年相关临床试验呈爆发式增长(上图)。近日,来自Kyverna Therapeutics及美国NCI的4位科学家在发表于Nature Reviews Immunology杂志上题为“Chimeric antigen receptor T cell therapy for autoimmune disease”的综述中指出,CAR-T细胞疗法有可能解决自身免疫性疾病的一系列致病机制,为这类疾病的治疗带来颠覆性的改变。来源:Nature Reviews Immunology在该文章中,科学家们系统总结了开发CAR-T细胞疗法治疗自身免疫性疾病的多项重要考虑因素,如哪种CAR结构最合适、何种程度的毒性是可接受的、是否需要预处理方案、是否可以实现持久的免疫重置或耐受。业界的共同期望是,CAR-T在自身免疫性疾病领域能够“大展拳脚”,带来新一轮的治疗变革。
CAR设计

CAR的关键组件(来源:Nature Reviews Immunology)CAR通常包括5个不同的结构域,每个结构域都可以经过设计以优化CAR-T细胞的功能。抗原识别结构域(antigen-recognition domain)通常是衍生自单克隆抗体单链可变片段(scFv),作用是实现HLA非依赖性抗原识别。一个铰链结构域(hinge domain)负责将抗原识别结构域连接到一个跨膜结构域(transmembrane domain)上。CAR的细胞质部分通常包括一个共刺激结构域(co-stimulatory domain,例如衍生自CD28或4-1BB的结构域)及一个T细胞激活结构域(T cell activation domain,几乎都是衍生自CD3ζ)(上图)。不同类型CAR构建体(来源:Nature Reviews Immunology)除了这类单特异性CAR,一些其他CAR设计也正在开发中(上图)。例如,双顺反子CAR结构使得同一T细胞可以靶向两种抗原。与仅靶向CD19的CAR相比,同时靶向CD19(以清除B细胞和一些浆细胞)和BCMA(以清除长寿命浆细胞)的双顺反子CAR结构可能在消除自身免疫诱导抗体方面更优越。T细胞受体(TCR)融合构建体(TRuCs)涉及scFv结构域与αβ TCR亚基的融合。在体外实验中,表达TRuC的T细胞表现出与表达CAR的T细胞相似的肿瘤细胞裂解水平,但表达TRuC的T细胞释放的细胞因子水平较低,这可能导致临床毒性较小。“装甲”CAR是将CAR表达与另一种蛋白(如细胞因子)的表达结合在一起。这种途径(如CD19CAR结合IL-10表达)有望降低自身免疫性疾病活跃部位的炎症。此外,致病性自身抗体可以作为CAR的抗原识别结构域的靶点,形成嵌合自身抗体受体(chimeric autoantibody receptor,CAAR)。CAAR-T细胞只破坏产生自身抗体的B细胞,有望避免全身免疫抑制的副作用。一旦抗原被CAR抗原识别区域识别,表达CAR的T细胞就会表现出包括细胞因子释放、细胞毒性和增殖在内的功能。CAR-T细胞疗法遇到的一些问题包括,非特异性(非靶向抗原)识别、T细胞过度激活导致高水平细胞因子释放以及激活诱导细胞死亡和T细胞耗竭。在治疗自身免疫性疾病时,CAR的应用尤其需要限制细胞因子释放综合征(CRS)和神经毒性,以建立更高的安全性标准。以下具体讨论每个CAR结构域的相关注意事项:
抗原识别结构域是决定CAR靶抗原识别敏感性和特异性的主要因素。对于靶向恶性肿瘤的CAR,必须有一个具有足够亲和力的结合域,以实现CAR能够被低水平的目标肿瘤细胞抗原激活。抗原识别结构域同时必须具有足够的特异性,以避免与非靶向细胞上的抗原发生交叉反应,否则可能导致严重的毒性。
CD19和BCMA是治疗自身免疫性疾病被研究最多的两种靶抗原。当靶向CD19或BCMA时,导致组织损伤的非特异性CAR活性不是主要问题,因为许多靶向这些抗原的CAR在肿瘤临床试验中已被证明具有可接受的毒性水平。一个问题是,CAR的潜在免疫原性。事实上,在接受了CAR-T细胞输注后,在接受者中监测到了针对CAR构建体的体液和T细胞反应,可能是针对非人CAR组成,包括非人抗体序列、scFvs中的人工连接肽,以及各组成之间的连接(如CD28序列和CD3ζ序列之间的连接)。一份报告显示,体内抗体可能通过与CAR中的scFv结合阻断CAR-T细胞的功能。为了克服免疫原性,研究人员开发出了由来自全人源或人源化抗体的抗原结合域组成的CAR,,并已进入临床试验,但其优于小鼠scFvs的优势尚未得到证实。对于抗CD19 CAR,由于B细胞被根除,抗CAR免疫反应可能会减少,这可能会减少针对CAR的抗体反应。然而,值得注意的一点是,自身免疫性疾病患者容易对外来蛋白产生免疫反应。数据显示,虽然仅在1%的非霍奇金淋巴瘤患者中观察到利妥昔单抗(一种抗CD20人-鼠嵌合抗体)的抗药抗体,但这一比例在系统性自身免疫性疾病患者中达到14%,在SLE患者中达到37%。相比之下,针对atumumab(一种全人源抗CD20单克隆抗体)的抗药物抗体分别在0%和0.2%的癌症和多发性硬化症患者中被检测到。
CAR的铰链结构域和跨膜(hinge and transmembrane,HTM)结构域能够强烈影响其功能。研究人员比较了仅HTM结构域(来自CD8α或CD28)不同的抗CD19CAR,结果显示,与表达含有CD28 HTM结构域的CAR的T细胞相比,表达含有CD8α HTM结构域的CAR的T细胞在体外释放的毒性细胞因子水平较低。同样,临床试验结果显示,与含有小鼠scFv和CD28 HTM结构域(FMC63-28Z)的抗CD19CAR相比,含有人scFv和CD8α HTM结构域(Hu19-CD828Z)的抗CD19 CAR的神经毒性发生率要低得多(分别为5%和50%)。在接受表达Hu19-CD828Z的T细胞治疗的患者中,毒性的降低与免疫调节因子(如颗粒酶A和CC趋化因子配体2)血清水平的降低有关。此外,重要的是,接受Hu19-CD828Z或FMC63-28Z CAR-T细胞治疗的患者的抗淋巴瘤结果非常相似。在另一项临床研究中,具有更长的CD8α铰链结构域的CAR-T细胞没有显示神经毒性,且只有轻度(1级)CRS;疗效方面,抗淋巴瘤活性与历史对照相似。
CAR中CD28或4-1BB共刺激结构域的存在增强了它们的功能和抗肿瘤活性,这两个结构域在B细胞淋巴瘤中显示出相似的临床结果,包括淋巴瘤反应率和无进展生存期。有一些证据支持,相比表达含有CD28共刺激结构域的CAR的T细胞,表达含有4-1BB的CAR的T细胞在体内的持久性更长(没有进行正式的临床比较)。对于自身免疫性疾病,目前尚不清楚理想的共刺激结构域是什么,但CAR设计的一个主要考量可能是最小化毒性。
CD3ζ结构域是几乎所有临床使用的CAR-T细胞的激活部分。每个CD3ζ结构域包含三个免疫受体酪氨酸激活基序(ITAMs),这些ITAMs的磷酸化对T细胞激活很重要,但也可以诱导细胞凋亡。研究显示,失活三个CD3ζ ITAMs中的两个可以改善小鼠CAR-T细胞的存活,因为激活诱导的细胞死亡减少了。另有研究表明,使用CD3δ而不是CD3ζ可能有优势。在小鼠模型中,含有CD3δ的CAR显示出更好的抗肿瘤活性,并在体外减少了细胞因子的产生。
迄今为止,在大多数自免疾病临床试验中使用的CAR-T细胞疗法的CAR基因都是使用慢病毒载体转导到患者T细胞中的。慢病毒基因转导的一个缺点是,由于慢病毒基因插入的非靶向性,可能会导致插入性突变,这可能是在少数接受CAR-T细胞治疗的癌症患者中观察到的T细胞淋巴瘤发展的原因。一些靶向插入基因的方法已经被开发出来,例如利用CRISPR-Cas9系统将CAR基因插入到T细胞中的TRAC(编码TCRα恒定区)位点。靶向CAR基因插入途径在临床上的应用是一个活跃的研究领域。
闯荡自免江湖

在急性淋巴细胞白血病和B细胞淋巴瘤中,抗CD19 CAR-T细胞疗法能够诱导B细胞的完全耗尽,这为使用抗CD19 CAR-T细胞治疗自身免疫性疾病提供了强有力的理论依据。然而,由于CAR-T细胞是由患者自身的淋巴细胞改造产生的,一个合理的担忧是转导了激活性CAR的自身反应性CD4 T细胞克隆会带来潜在的疾病增强效应。不过,在狼疮小鼠模型中的研究显示,只使用CD8 CAR-T细胞或者使用CD4 CAR-T细胞和CD8 CAR-T细胞混合物对于组织驻留B细胞具有同等有效的清除作用,均改善了疾病和小鼠生存。这些结果表明,自身反应性CD4 T细胞的转导可能不会限制CAR-T疗法治疗自身免疫性疾病的使用。
表1 部分已经发表的B细胞靶向CAR-T细胞治疗自身免疫性疾病的临床证据
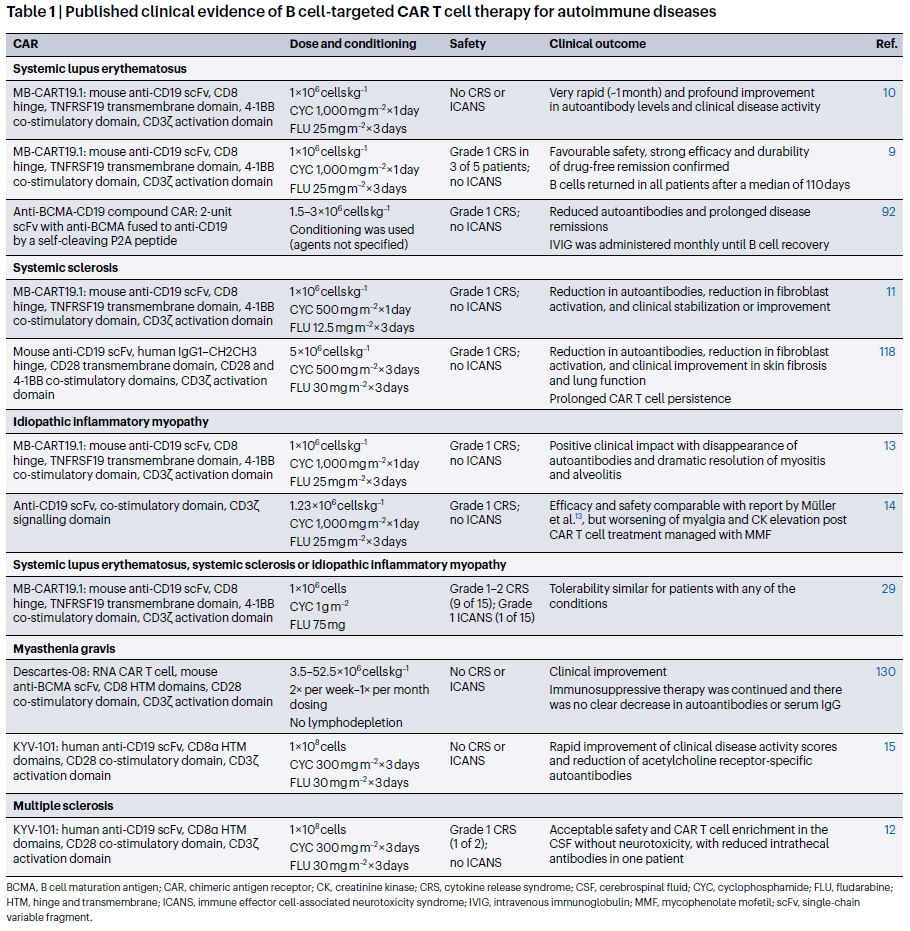
来源:Nature Reviews Immunology
此外,最近有研究显示,由CD3淋巴细胞(unfractionated CD3 lymphocytes)开发的抗CD19 CAR-T细胞也显示出治疗自身免疫性疾病的潜力。一例20岁严重难治性SLE患者的病例报告就是一个值得注意的例子。患者有多种狼疮表现,多种免疫抑制剂(包括B细胞靶向生物制剂,如belimumab、rituximab)难以治疗。而输注自体抗CD19 CAR-T细胞导致疾病表现快速得到解决,重要的是,治疗耐受性良好,没有CRS或神经毒性的证据。同一研究中的其他4例难治性SLE患者疾病情况也显示类似速度的缓解(均在3个月内达到缓解),且相比治疗肿瘤安全性特征更胜一筹。在所有5个病例中,外周B细胞在CAR-T输注后的几个月内被耗尽到无法检测的水平,大多数致病性自身抗体降低到正常水平。同样,其他报道显示,CAR-T细胞治疗难治性抗合成酶抗体综合征、系统性硬化症和重症肌无力患者也取得了显著的疗效。在这些患者中,CAR-T细胞也具有良好的耐受性。在多发性硬化症中,CAR-T细胞疗法同样显示了良好的耐受性及潜在的疗效。这些结果支持利用CAR-T清除B细胞群以治疗不同B细胞驱动自身免疫性疾病更进一步的研究。这类细胞疗法有望实现自身免疫性疾病前所未有的的控制水平。部分正在进行的CAR-T细胞治疗自身免疫性疾病的相关临床试验见表2。
表2 部分正在进行的抗CD19和抗BCMA CAR-T细胞治疗自身免疫性疾病的临床试验

注:该综述上线日期为2024年6月3日,数据或有更新(来源:Nature Reviews Immunology)
接受CAR-T细胞治疗的自身免疫性疾病患者发生CRS和ICANS的风险在很大程度上仍然未知。由于自身免疫性疾病患者无恶性肿块或恶性细胞骨髓浸润(均与CRS和ICANS相关),因此与接受CAR-T细胞治疗的恶性肿瘤患者相比,他们的毒性可能更小。一些早期利用CD19 CAR-T治疗自身免疫性疾病的研究支持这一假设。到目前为止,由CRS、ICANS和血细胞减少引起的毒性病例的级别较低,而且很容易利用标准治疗加以控制。肿瘤CAR-T细胞治疗后感染很常见,已上市产品的临床试验中,有5%-32%的患者报告了3-5级感染。在自身免疫性疾病患者中,迄今为止的研究结果表明,更轻的细胞毒性治疗史以及更早、更连续的B细胞补充,可能有助于这类患者治疗后感染风险更低。因此,对于自身免疫性疾病患者来说,与需要长期给药导致外周血B细胞数量持续降低(导致感染风险增加)的抗B细胞单抗相比,抗CD19 CAR-T细胞引发的深入但短期的B细胞清除可能会带来可接受的、具有优势的安全性。
在CAR-T治疗自免疾病方面,一个值得关注的问题是,抗CD19 CAR-T细胞会消耗大量的B细胞,其中包括自身反应性B细胞和非致病性B细胞,这会使患者处于感染的风险中,直到B细胞恢复。为了更有选择性地清除自身反应性B细胞,有研究团队设计了CAAR-T细胞。CAAR全称为chimeric autoantibody receptor,包含一个由自身抗体靶蛋白(自身抗原)组成的胞外结合域。在寻常型天疱疮和MuSK重症肌无力小鼠模型中开展的临床前研究为CAAR-T细胞疗法提供了概念验证。名为Cabaletta的公司正在进行CAAR-T治疗粘膜性天疱疮(NCT04422912)和MuSK重症肌无力(NCT05451212)的I期临床试验。Treg细胞恢复免疫稳态的治疗潜力一直被看好。Treg细胞通过多种机制抑制炎症和自身免疫,包括通过表达negative调节性细胞表面受体产生直接的抑制性细胞-细胞相互作用,或者通过产生抑制性可溶性介质(如IL-10、TGFβ)间接发挥作用。使用体外扩增多克隆Treg细胞的临床研究表明,它们在患有各种自身免疫性疾病的患者中具有良好的耐受性,在移植后至少在循环中持续存在1年。不过,到目前为止,这类疗法尚未显示令人振奋的临床疗效。相比之下,抗原特异性Treg细胞更有效,在小鼠模型中表现出改善的功能(抗原特异性靶向Treg细胞可以通过更少的细胞带来有效的局部免疫调节作用,同时潜在地减少更广泛的免疫抑制)。Treg细胞可用于控制多种靶细胞。例如,尽管B细胞消耗一直是抗CD19 CAR-T细胞疗法的主要目标,但控制自身抗体的产生也可以通过抗CD19 CAR-Treg细胞方法来实现,且这种方法不需要完全清除靶细胞群(Treg细胞抑制免疫系统以恢复体内平衡,而大多数CAR-T细胞的功能是破坏目标细胞)。有研究显示,源自人类外周血单核细胞的抗CD19 CAR-Treg细胞移植到免疫缺陷小鼠中后,能够通过TGFβ依赖性机制抑制IgG抗体的产生和B细胞的分化。小鼠抗CD19 CAR-Treg细胞也能抑制急性移植物抗宿主病,同时维持移植物抗肿瘤反应。
与CAR-T细胞疗法相比,CAR-Treg细胞疗法CRS风险很小,因为稳定的Treg细胞不产生促炎细胞因子。开发工程化Treg细胞的一个关键考虑因素是确保调节性表型(regulatory phenotype)的稳定性,以避免转化为效应T细胞(ex-Treg细胞)。Treg细胞的稳定性与FOXP3的稳定表达和X染色体Treg细胞特异性去甲基化区域的去甲基化相关。科学家们正在寻求多种方法来开发稳定的CAR-Treg细胞,例如在强启动子的控制下增强FOXP3的表达,或通过基因编辑方法实现FOXP3的异位表达。
Treg细胞在1型糖尿病(T1D)中的作用已被广泛研究。有研究表明,靶向胰岛抗原的CAR-Treg细胞在预防T1D方面取得了显著的效果。此外,CAR-Treg细胞疗法在炎症性肠病、多发性硬化症等疾病中的应用也有报道。一家名为Sonoma的公司的具体思路是通过CAR将Treg细胞引导到炎症“热点”。该公司的主要资产SBT-77-7101可识别瓜氨酸化蛋白,这些修饰蛋白存在于炎症部位,如类风湿关节炎患者的关节和化脓性汗腺炎患者的皮肤结节。SBT-77-7101正处于治疗这两种疾病的I期临床试验中。
尽管使用不同的CAR共刺激结构域在CAR-T细胞疗法的临床结果方面没有明显差异,但CD28共刺激在Treg细胞发育中起关键作用,CD28在CAR-Treg细胞功能中比4-1BB更重要。与CD28相比,含有4-1BB的CAR-Treg细胞表现出谱系稳定性下降和体内抑制能力下降。不过,也有研究表明,表达带有或不带有CD28结构域的CAR的Treg细胞在功能上是相同的。对这方面的理解仍在不断更新。Treg细胞同样可以被改造以表达额外的细胞表面蛋白或可溶性蛋白,如趋化因子受体、细胞因子(如IL-10)或者FOXP3等(下图)。有研究显示,同时能够表达IL-10的CAR-Treg细胞,会导致IFNγ、IL-2、IL-17、IL-4和肿瘤坏死因子显著减少或清除。
工程改造Treg细胞(来源:Nature Reviews Immunology)
其他要点
在治疗癌症时,通常认为有必要在CAR-T细胞治疗之前进行条件化疗(常用的是低剂量环磷酰胺-氟达拉滨方案),以通过多种机制确保输注的CAR-T细胞的疗效,包括清除Treg细胞、骨髓来源的抑制性细胞,以及增加血清细胞因子(如IL-15和IL-7)的可用性。自身免疫性疾病患者的最佳化疗调节方案尚不清楚,但环磷酰胺-氟达拉滨已成功应用于抗CD19 CAR-T细胞治疗自身免疫性疾病。这种组合通常耐受性良好,最常见的化疗相关不良事件是轻度恶心、疲劳和血细胞减少。不过,环磷酰胺是已知的继发性髓系恶性肿瘤的促成因素,并能够损害生育能力,这对于患有自身免疫性疾病的年轻,主要是女性患者群体尤其值得关注。此外,罕见的氟达拉滨相关视力丧失也有报道。考虑到与肿瘤适应症相比的获益-风险差异,有必要研究用于自身免疫性疾病的毒性较小的调理方案。
值得一提的是,用于治疗慢性自身免疫性疾病的免疫抑制药物可能会干扰CAR-T细胞的生产和功能,因此需要在采血和CAR-T细胞输注之前减少用药或停药。对于疾病活跃的患者,完全不用可能不行,可以使用低剂量类固醇。最近,有证据表明,一些类固醇可以耐受,且不影CAR-T细胞的抗肿瘤作用。
通过CAR-T细胞疗法全面消除致病B细胞可能允许免疫系统“重置”。目前的证据表明,尽管B细胞恢复,疾病的改善仍可能维持。在首次报道的5例接受抗CD19 CAR-T细胞治疗的SLE患者中,naïve B细胞平均在110±32天后恢复,但在CAR-T细胞输注后长达12个月的随访中,没有患者报告疾病复发。值得一提的是,自身免疫性疾病患者的B细胞相对较早“恢复”,而肿瘤患者的B细胞可能在中位时间12个月后(范围为2-59个月)恢复,部分原因可能是由于自身免疫性疾病患者先前接受的清淋和抗CD20治疗更少。值得注意的是,抗CD19 CAR-T细胞输注后观察到的重新出现的B细胞的naive表型与清髓调节和自体造血干细胞移植后报告的类似。
小结
CAR-T这辆“小车”自2017年8月正式“上路”以来一直备受瞩目,其“治愈”癌症的潜力也推动了CAR-T研发的产业热潮。而最近两三年的研究成果显示,除了癌症,CAR-T在自免领域也有望掀起治疗变革。与单抗疗法相比,CAR-T细胞能够更加彻底地清除组织驻留的B细胞,从而带来多种自免疾病的持久缓解,这将是相比传统疗法的巨大进步。
-上下滑动查看参考资料 -
[1]https://www.nature.com/articles/s41577-024-01035-3
[2]https://www.nejm.org/doi/10.1056/NEJMoa2308917[3]https://www.cell.com/cell/abstract/S0092-8674(24)00701-3[4]https://www.nejm.org/doi/full/10.1056/NEJMc2403743[5]https://mp.weixin.qq.com/s/RpyB_1OMoCCgdx_dyuOxhw[6]https://ir.kyvernatx.com/news-releases/news-release-details/first-disease-



