近一个月药物审批进展概览
2024-10-11 10:43:52
本文梳理了近一个月(2024年8月16日~2024年9月15日)在研药物的审批情况,同时,对部分药物的研究情况进行简述和分析,供研发人员参考。据统计,在2024年8月16日~2024年9月15日期间,共有8个药物获批上市(表1)。这些药物涉及的适应症包括遗传性血管性水肿、非小细胞肺癌(NSCLC)、斑块银屑病、弥漫性大B-细胞淋巴瘤、滤泡性淋巴瘤、特应性皮炎、多发性硬化症。以下对重点药物进行介绍和分析。
表1:近一个月(2024年8月16日~2024年9月15日)的药物批准情况
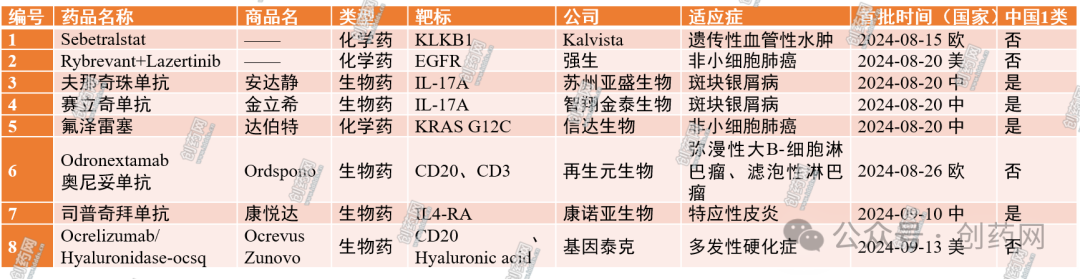
Lazcluze(Lazertinib,拉泽替尼)是口服第三代脑渗透性表皮生长因子受体(EGFR)酪氨酸激酶抑制剂,可靶向T790M突变和激活性EGFR突变,同时保留野生型EGFR。最初在韩国获批;2024年1月在美国获批用于治疗具有EGFR外显子19缺失或L858R替代突变的NSCLC患者。Rybrevant(Amivantamab-vmjw,埃万妥单抗)是EGFR和MET双特异性抗体,具有多重抗癌作用机制,能阻断EGFR和MET介导的信号传导,并引导免疫细胞靶向携带激活性和耐药性EGFR/MET突变和扩增的肿瘤;2021年5月获美国FDA批准,用于治疗EGFR外显子20插入突变且接受铂类化疗过程中或化疗后病情进展的NSCLC患者。2024年8月19日,FDA批准强生公司的Lazcluze联合Rybrevant用于经FDA批准的检测方法检测出EGFR外显子19缺失或外显子21 L858R置换突变的局部晚期或转移性NSCLC成年患者。凭借此项批准,该组合疗法已成为首个也是唯一一个多靶标、无化疗组合疗法,且在EGFR突变NSCLC一线治疗中表现出优于Osimertinib(奥希替尼)。本次批准基于Ⅲ期MARIPOSA(NCT04487080)试验的数据支持。该试验招募了1074名具有EGFR外显子19缺失或外显子21 L858R替代突变的局部晚期或转移性NSCLC成人患者。患者随机(2:2:1)分为三组,分别接受Lazcluze联合Rybrevant治疗、奥希替尼单药治疗或Lazcluze单药治疗。主要终点是中位无进展生存期(PFS),其他结果指标包括总生存率、总缓解率和缓解持续时间(DOR)。研究结果显示:Lazcluze联合Rybrevant治疗组的中位PFS为23.7个月,奥希替尼组为16.6个月,联合疗法将疾病进展或死亡的风险降低了30%,联合疗法的DOR为25.8个月,奥希替尼组为16.8个月。联合疗法的客观缓解率为86%,奥希替尼组为85%。最常见的不良反应(≥20%):皮疹、指甲毒性、Rybrevant输液相关反应、肌肉骨骼疼痛、水肿、口腔炎、静脉血栓栓塞、感觉异常、疲劳、腹泻、便秘、COVID-19感染、出血、皮肤干燥、食欲下降、瘙痒、恶心和眼部毒性。严重不良反应:静脉血栓栓塞事件,FDA建议在治疗的前4个月给予患者预防性抗凝治疗。近日,NMPA通过优先审评审批程序附条件批准信达生物1类创新药氟泽雷塞片(商品名:达伯特)上市,该药适用于至少接受过一种系统性治疗的鼠类肉瘤病毒癌基因(KRAS)G12C突变型的晚期NSCLC成人患者,为患者提供新的治疗选择。从机制上,氟泽雷塞通过共价不可逆修饰KRAS G12C蛋白突变体半胱氨酸残基,抑制该蛋白介导的GTP/GDP交换从而下调KRAS蛋白活化水平;临床前半胱氨酸选择性测试也显示了氟泽雷塞对于该突变位点的高选择性抑制效力。此外,氟泽雷塞抑制KRAS蛋白后可进而抑制下游信号传导通路,诱导肿瘤细胞凋亡及细胞周期阻滞,达到抗肿瘤效果。达伯特是首个国产的KRAS G12C抑制剂,填补了国内KRAS突变肺癌靶向治疗空白,将为患者带来精准治疗全新方案。在这项中国开展的开放标签、单臂Ⅱ期注册临床研究(NCT05005234)中,旨在评估氟泽雷塞单药在标准治疗失败或不耐受且携带KRAS G12C突变的晚期NSCLC患者中的安全性、耐受性和疗效。截至2023年12月13日,共纳入了116例NSCLC患者。研究结果显示,根据独立影像学评审委员会(IRRC)评估的确认的客观缓解率(ORR)为49.1%,疾病控制率(DCR)为90.5%。此外,中位DOR未达到,PFS为9.7个月;中位生存期(OS)尚未达到,12个月OS率为54.4%。在安全性方面,与既往报道一致,氟泽雷塞总体耐受性良好,未提示新的安全性信号。截至数据分析日,共有92.2%(107/116)的受试者发生药物相关不良事件(TRAEs),大部分为1~2级,最常见的TRAE为贫血、丙氨酸氨基转移酶升高、天门冬氨酸氨基转移酶升高、乏力和蛋白尿。
- 1. Informa数据库, 检索日期: 2024年9月19日.
- 2. 药渡数据库, 检索日期: 2024年9月18日.



