单核/巨噬细胞流式解决方案
2022-10-24 10:50:00
单核细胞在脉管系统、骨髓和脾脏中循环,其在稳态下不增殖。一旦单核细胞迁移到外周组织,就会分化为树突状细胞或巨噬细胞。单核细胞的特征是可塑性和异质性,因为它可以快速调整其功能表型以响应变化的机体环境。巨噬细胞存在于大部分组织中,因此具有不同的功能,除了能启动对病原体的免疫反应和炎症反应,巨噬细胞还维持组织稳态以及组织的修复和重塑发挥作用。
经典型、中间型和非经典型。

可以从PBMC中通过阴选试剂盒分离较纯的、有活性的单核细胞。也可以用CD14、CD64和CD192作为人单核细胞的特异性标志物通过流式分选出单核细胞。
原代人单核细胞可以在体外培养,需要注意的是,在血清或M-CSF存在的5天内,培养的单核细胞将开始分化为巨噬细胞。单核细胞以粘附和非粘附细胞的混合形式生长,粘附细胞的比例取决于培养基和刺激因子。除了原代单核细胞,人外周血单核细胞系THP-1也常用于对单核巨噬细胞系统的研究。
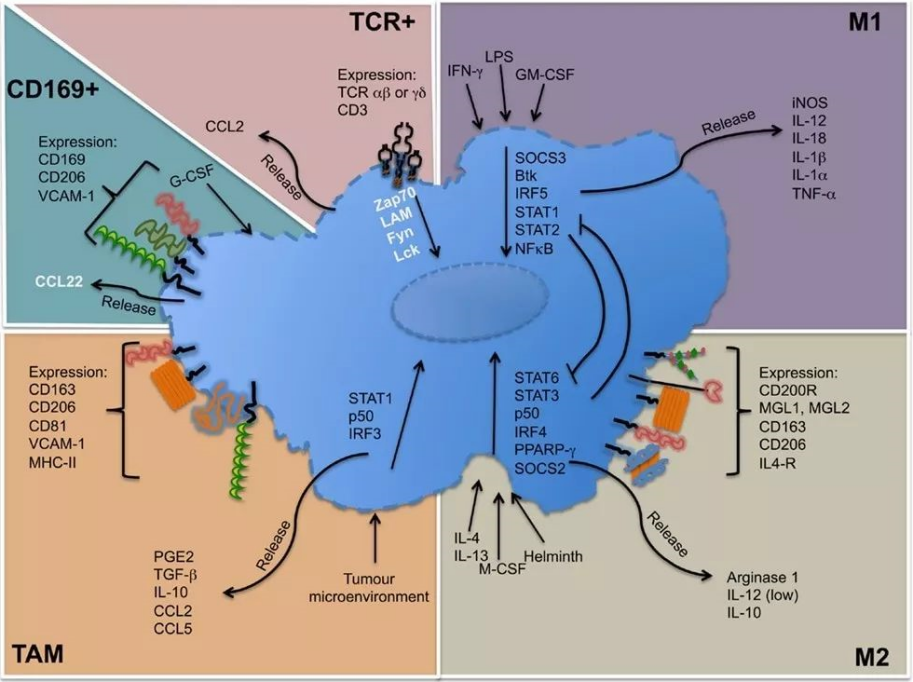
Panmarker:人CD68,小鼠F4/80
单核细胞、巨噬细胞(Kupffer细胞)、树突状细胞表型
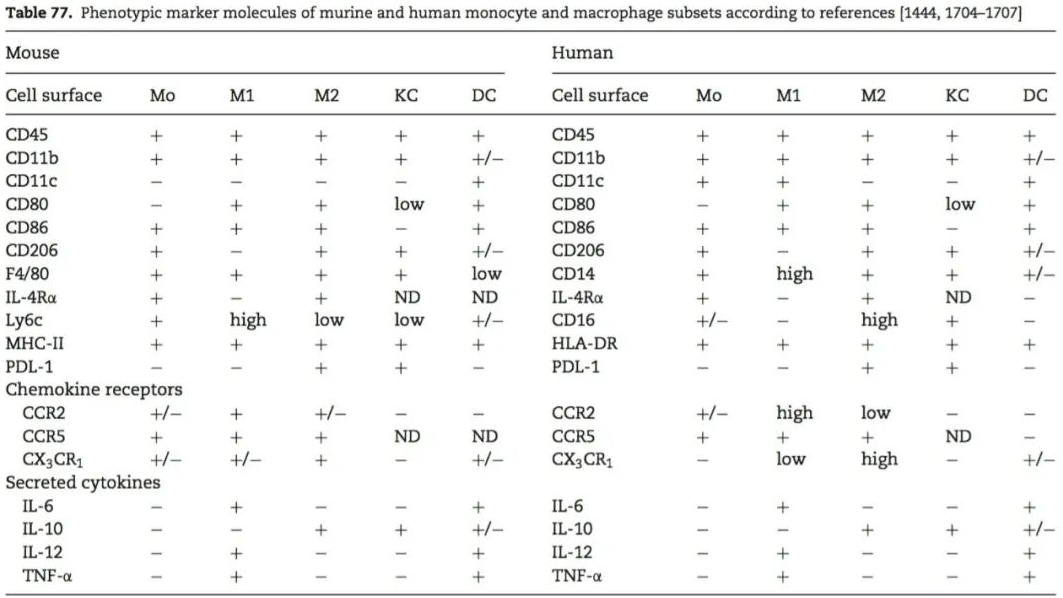
Guidelinesfor the use of flow cytometry and cell sorting in immunologicalstudies(second edition). Eur. J. Immunol. 2019. 49: 1457–1973
巨噬细胞通常存在于组织中,所以分析巨噬细胞时,需要先处理组织,比如解剖、研磨、剪碎等,然后进行酶消化,制备单细胞悬液。此外,在最终上机检测前建议将样本过滤,以保证检测的准确性和避免堵管。
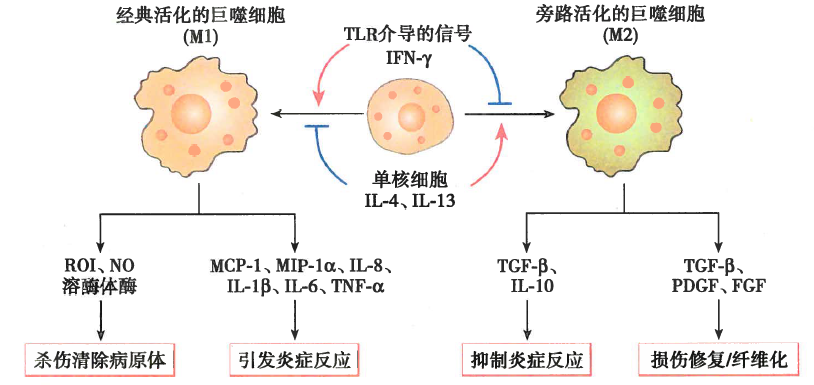
分离的单核细胞可以使用特殊的分化培养基分化成巨噬细胞。使用生长因子GM-CSF和M-CSF可以使单核细胞分化成巨噬细胞。在1640培养基中刺激单核细胞,培养基中添加10%FCS和10ng/mLGM-CSF或10ng/mLM-CSF持续7天,能导致M1或M2极化。刺激后,细胞贴壁生长。
另外,可以用不同的细胞因子先后刺激单核细胞来获得M1和M2极化。用含10%FCS的1640培养基培养得到的细胞,随后用10ng/mLLPS处理24小时和50ng/mLIFN-γ以获得M1巨噬细胞或添加20ng/mLIL-4可获得M2/M2a巨噬细胞。用免疫复合物和IL-1或LPS处理能促进M2b活化,加入IL-10、TGF-β或糖皮质激素则能促进M2c活化。若要获得THP-1来源的巨噬细胞,可以用PMA刺激6小时,诱导细胞分化为巨噬细胞。然后,在PMA继续存在的情况下,分别通过IFN-γ(20ng/ml)和LPS(100ng/ml)培养48小时以上,使其向M1极化,或者IL-4(20ng/ml)和IL-13(20ng/ml)培养48小时以上,使其向M2极化。




