抗体药物飞速发展的40年
2025-02-20 14:44:07
前言
抗体药物是生物医药领域最具革命性的突破之一,凭借高特异性、低毒性和广泛的治疗潜力,已成为全球制药市场增长最快的细分领域。自1986年首个单克隆抗体获批以来,抗体技术历经鼠源、嵌合、人源化到全人源抗体的迭代,逐步解决了免疫原性和疗效问题。目前,抗体药物已覆盖癌症、自身免疫病、感染性疾病等多个领域,市场规模在2021年达到2173亿美元,年增长率约15%。然而,其发展仍面临靶点限制、胞内递送难题、生产工艺复杂等挑战。本文系统梳理抗体药物的发展脉络、作用机制及产业化趋势,以期为行业提供全景视角。
-02-
治疗性抗体的发展阶段
抗体药物的发展可分为四个阶段:鼠源性抗体、嵌合抗体、人源化抗体和全人源抗体。早期鼠源抗体因免疫原性强,易引发人抗鼠抗体(HAMA)反应,临床应用受限。1990年代,嵌合抗体(如抗CD20抗体利妥昔单抗)通过替换人源Fc段减少免疫原性,成为首个成功商业化的治疗性抗体。随后,人源化技术通过仅保留鼠源互补决定区(CDR),进一步优化安全性,代表性药物如曲妥珠单抗。2010年后,全人源抗体(如阿达木单抗)通过噬菌体展示或转基因小鼠技术实现完全人源化,显著降低免疫原性并扩大适应症。
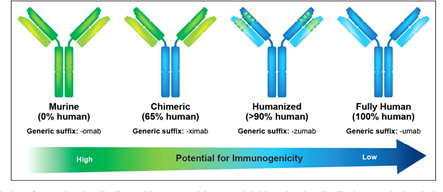
目前,全人源抗体已成为主流,但技术壁垒仍高。例如,全人源抗体的亲和力优化和规模化生产仍需突破。此外,新型抗体(如纳米抗体、双抗)的涌现推动技术向更高维度发展。
-03-
现有抗体药物的常见MOA包括(i)配体-受体相互作用的破坏;(ii)通过抗体依赖性细胞毒性(ADCC)、补体依赖性细胞毒性(CDC)和抗体依赖性细胞吞噬(ADCP)清除靶细胞;(iii)双特异性抗体T细胞结合器;(iv)通过增强内化和降解来下调受体;(v)靶向给药。
阻断配体-受体相互作用
配体-受体相互作用是许多细胞事件信号转导的初始步骤,包括细胞增殖、粘附和迁移,其中一些与癌症进展有关。结合配体-受体界面两侧的抗体可以破坏结合,干扰信号转导,从而阻止疾病进展。例如,贝伐单抗(Avastin)是2004年开发并批准用于治疗结直肠癌的第一种抗血管生成抗体药物。贝伐单抗的信号阻断抑制血管生成信号,降低肿瘤细胞血供,导致肿瘤缩小。
通过ADCC和CDC的细胞清除
大部分单克隆抗体的治疗活性源于Fc受体结合区域的效应器功能,这些效应器功能包括ADCC、ADCP和CDC。对于可溶性配体,单克隆抗体结合形成免疫复合物,可被效应细胞消除;对于细胞表面受体,单克隆抗体结合的细胞可被效应细胞攻击,导致细胞破坏和死亡。FDA批准第一个CD20嵌合抗体利妥昔单抗用于治疗非霍奇金淋巴瘤。利妥昔单抗的效力主要来自抗体参与的效应器功能,包括CDC、ADCP和ADCC。
双特异性抗体T细胞结合器
在许多抗肿瘤效应中,细胞毒性T细胞起着至关重要的作用,然而,抗肿瘤T细胞反应受到癌细胞免疫逃逸机制的限制。以T细胞受体为靶点的单克隆抗体可以模拟抗原识别的效果,诱导特异性T细胞增殖,并释放细胞毒性因子,如IL-2和INF-γ。为了将T细胞导向肿瘤细胞,人们设计了双特异性T细胞接合器。这种双特异性分子一边结合靶肿瘤细胞上过表达的细胞表面抗原,另一边结合T细胞受体中的CD3。从而在肿瘤细胞和T细胞之间架起桥梁,激活T细胞破坏肿瘤细胞。第一个针对CD19和CD3的双特异性T细胞结合器,即blinatumomab,于2014年12月在美国被批准用于治疗急性淋巴细胞白血病(ALL)。
通过增强内化和降解实现受体下调
尽管人类IgG1可以招募免疫细胞来破坏肿瘤细胞,但是用西妥昔单抗(IgG1)或帕尼妥单抗(IgG2)靶向EGFR,单一疗法的应答率分别仅为11%和8%。对于抗EGFR和HER2,观察到通过抗体结合的非重叠表位协同下调受体酪氨酸激酶,从而更有效地阻断EGFR信号。这种方法可能代表了抗体疗法的一种新策略。
靶向给药
通过抗体增强靶向给药的方式包括抗体偶联药物(ADC)和抗体免疫脂质体药物(IML)。ADC药物的MOA包括四个步骤:抗体与靶抗原结合、抗原抗体复合物内化、细胞内药物释放,以及有效载荷发挥作用,包括破坏DNA和微管,以及中断DNA合成等。靶向给药的效率取决于抗原抗体复合物的内化和ADC的细胞内分解,这可能受到抗原内吞特性和抗原抗体结合特性的影响。
与ADC的情况不同,ADC每个抗体只能携带几个药物分子,每个免疫脂质体封装超过10000个药物分子,允许使用效力较低的化疗药物。此外,与其他ADC相比,免疫脂质体可能具有额外的优势,因为它可以使用相同的靶向颗粒来封装用于治疗的毒性药物和用于肿瘤可视化的放射性同位素。
-04-
抗体偶联药物是由靶向特异性抗原的单克隆抗体与小分子细胞毒性药物通过连接子链接而成,兼具传统小分子化疗的强大杀伤效应及抗体药物的肿瘤靶向性。ADCs于20世纪90年代中期首次进入临床试验以来,经过近30年的发展,已经成为一个非常成功的肿瘤学平台。2009年gemtuzumab ozogamicin(Mylotarg) 是FDA批准的第一个ADC药物。目前,全球已上市16款ADC药物。2009年,卡利霉素、金盏花素和美登素类药物是用于ADC开发的主要细胞毒素。十年来,这些分子仍然被用作有效载荷进行优化,以获得更好的稳定性和亲水性。新的细胞毒性物质也被开发出来,如PBDs、杜卡霉素和喜树碱衍生物等。抗体工程在10年间也已经取得了相当大的进展,允许更多的位点特异性偶联,提高了ADC的均一性和稳定性。近年来,ADC在实体瘤和血液瘤中取得突破。例如,DS-8201(靶向HER2)通过可裂解连接子搭载拓扑异构酶抑制剂,显著延长乳腺癌患者生存期。然而,脱靶毒性、耐药性和生产工艺复杂性仍是主要挑战。-05-
单克隆抗体因其特异性靶向分子的能力,已成为癌症治疗中一种关键而有效的治疗方式。然而,由于肿瘤复杂的疾病发病机制,针对单一靶点的单克隆抗体往往不足以表现出足够的治疗效果。因此,针对多个靶点的双特异性抗体(bsAbs)应运而生,它的发展改变了肿瘤免疫治疗的领域。根据其功能机制,BsAb可分为4类:结合同一抗原的两个表位、细胞-细胞接合器、双功能调节剂和细胞治疗中的BsAb。2014年,首个靶向CD19/CD3ε的双特异性T细胞接合器(BiTE)blinatumomab被FDA批准用于治疗急性淋巴细胞白血病(ALL)。自那时起,bsAbs掀起了一阵开发热潮。截至2020年底,有三种bsAbs(catumaxomab、blinatumomab和emicizumab)获得批准。尤其最近几年,3年中新增了11种bsAbs获得了监管机构的批准,其中9种被批准用于治疗癌症(amivantamab, tebentafusp, mosunetuzumab, cadonilimab, teclistamab, glofitamab, epcoritamab, talquetamab, elranatamab) ,2种用于非肿瘤适应症(faricimab, ozoralizumab) 。-06-
抗体融合蛋白通过将功能蛋白(如细胞因子、受体)与抗体Fc段结合,延长半衰期并增强效应功能。抗体融合蛋白典型代表包括:依那西普(TNFR-Fc)通过中和炎症因子治疗类风湿关节炎;凝血因子Ⅸ-Fc融合蛋白将半衰期从18小时延长至100小时,减少血友病患者注射频率。此外,细胞因子与抗体或抗体片段的融合可能导致更具针对性的TAA,这可能会提高细胞因子的疗效、药代动力学和局部浓度,并防止全身毒性。该领域的发展重点在于优化融合构象与功能协同性。-07-
F(ab')2,是一种分子量为110kDa的二价片段,由两个通过铰链区连接在一起的Fab片段组成。由于尺寸较小,它们比单克隆抗体具有更好的渗透性。NMPA批准了Metuximab-I131,一种放射性碘[131I]标记的抗CD147 F(ab')2单抗,用于治疗肝癌。目目前,FDA没有批准癌症治疗的F(ab')2药物。单链抗体由重链(VH)和轻链(VL)的可变区域组成,它们通过柔性肽接头连接在一起。单链抗体可在大肠杆菌中表达,在肿瘤中显示出良好的渗透性。目前,在癌症治疗的临床试验中,正在开发几种单价单链抗体融合蛋白,包括L19-IL-2、rM28、D2C7-IT(I期)和Vicinium(III期)。纳米抗体是在自然界中存在的一些奇特的小分子抗体,它们分子量比较小,可变区即是获得具有抗原结合能力的结构域。FDA和EMA批准的第一种VHH药物caplacizumab(Ablynx Inc),是一种用于治疗成人获得性血栓性血小板减少性紫癜的人源化抗VWF VHH。临床上正在研究各种VHH,以评估其用于不同目的的效果,包括癌症治疗。例如,目前正在评估抗EGFR VHH、抗HER2 VHH、抗VEGFR2 VHH、抗c-Met VHH、和抗CXCR7 VHH。两个VHH正在进行癌症治疗的I期临床试验,Ablynx的抗CXCR4 VHH(ALX-0651)和诺华的新型激动性四价抗DR5 VHH(TAS266)。-08-
抗药抗体(Anti-drug antibody, ADA)是抗体药物免疫原性评价的主要方式。ADA的形成可以分为与患者相关的因素和与药物相关的因素。1.遗传因素:病人ADA出现和病人当时的免疫状态,主要组织相容性和人类白细胞抗原等位基因的差异相关。2.患者疾病状态:例如有无过往的微生物和病毒感染史;单克隆抗体的免疫原性可能与年龄有关,即儿童的蛋白质周转率与成人不同,这可能导致观察到的免疫原性不同;疾病相关因素也强烈影响免疫原性;先前接触过类似或相关的单克隆抗体也会影响免疫原性。3. 给药方案:重复给药或间歇给药比一次性使用的单克隆抗体诱导免疫原性的可能性更高;如联合使用免疫抑制剂,ADA会降低;1.抗体源性:尽管为了降低免疫原性,先后开发了嵌合抗体,人源化抗体和全人源单抗,但是人源化改造,并没有完全消除ADA,即使人源化抗体的CDR区,依然有强的免疫原性,产生抗独特型抗体。2.配方、容器系统、储存条件会影响产品的免疫原性。这些因素可能通过成分与治疗蛋白质和容器封闭系统的相互作用影响免疫原性,例如蛋白质构象的改变、作为免疫佐剂的杂质的提取、引起诸如聚集、微粒或脱酰胺等改变。3.改变的糖基化模式可降低或增强分子的免疫原性,例如通过屏蔽蛋白质主干或通过Toll样受体触发先天免疫应答。4. 非典型的糖基化模式,例如可能发生在全新的表达系统中,与通常使用的表达系统相比,可能引起免疫原性的改变。5.其他有助于免疫原性的因素包括产生方法、途径、剂量和给药频率产生的杂质。
抗体药物的开发和发展是高度动态变化的,了解抗体药物的产业化趋势有助于我们发现和设计更具开发潜力的候选药物。基于截至2020年6月批准的89种抗体药物的信息,有82种(92%)是全长的单克隆抗体,有1个是全长IgG的双特异性抗体(emicizumab)。在剩下的六个中,一个是双特异性T细胞结合器(blinatumomab);三种是抗原结合片段(Fab),包括abciximab, idarucizumab和anibizumab;一种是Fab’(certolizumab pegol)。大多数上市的抗体药物使用的重链亚型是IgG1,占到统计的抗体药物的72.4%,另外分别有12个使用了IgG2重链和IgG4重链。近年来,ADAs发生率较低的抗体得到了更多的批准。1998年获批的曲妥珠单抗成为第一个ADA发生率低于1%的抗体药物。在所有统计的89个抗体药物中,ADA的平均报告发生率为11.3 ± 8.0%;其范围从bezlotoxumab的0%到alemtuzumab的62%。抗体药物的产品形式包括西林瓶、预先填充的注射器或注射笔以及冻干粉。多年来,西林瓶一直是市场上抗体药物最常见的产品形式,占到了55.2%。在其余产品形式中,冻干粉的形式占到22.9%,预填充注射器或注射笔占到21.9%。抗体药物的给药途径包括皮下、静脉注射和其它如皮内、玻璃体内等。在这89种抗体药物中,约三分之二(66.2%)是静脉注射,另有27种(30.4%)是皮下注射。在剩下的三种药物中,分别是皮内(racotumomab)、肌肉内(palvizumab)和玻璃体内(ranibizumab)给药途径。82种全长抗体的半衰期从17小时(sacituzumab goitecan)到50天不等(ravulizumab),平均值为14.5天;大多数上市的抗体药物在15至25天之间被清除。制剂是生物药开发的一个重要方面,对稳定性、安全性、药理学以及给药途径都有重要影响。在89种抗体药物中,87种使用缓冲液,35种使用张力调节剂,60种使用稳定剂,79种使用表面活性剂。-10-
抗体药物历经四十年发展,已成为现代医学的支柱之一。从单抗到ADC、双抗,技术创新不断拓展治疗边界;从静脉注射到长效制剂,患者依从性持续改善。未来,随着人工智能驱动的抗体设计、新型偶联技术及全球化产能布局的发展将推动抗体药物行业迈向黄金的新纪元。
参考文献:
1. Emergingnew therapeutic antibody derivatives for cancer treatment. Signal TransductTarget Ther. 2022; 7: 39.2. Antibody–Drug Conjugates: The Last Decade. Pharmaceuticals 2020, 13, 2453. The Chemistry Behind ADCs. Pharmaceuticals (Basel). 2021 May; 14(5): 442.4. Anticancer bispecific antibody R&Dadvances: a study focusing on research trend worldwide and in China. J HematolOncol. 2021; 14: 124.5.Trends in industrialization of biotherapeutics: a survey of product characteristics of 89 antibody-based biotherapeutics. MAbs.2023 Jan-Dec;15(1):2191301.6.Development of Bispecific Antibody for CancerImmunotherapy: Focus on T Cell Engaging Antibody. Immune Netw. 2022 Feb; 22(1): e4.7. A pivotal decade for bispecific antibodies?. MAbs. 2024 Jan-Dec;16(1):2321635.



