


01
介绍
- Introduction -
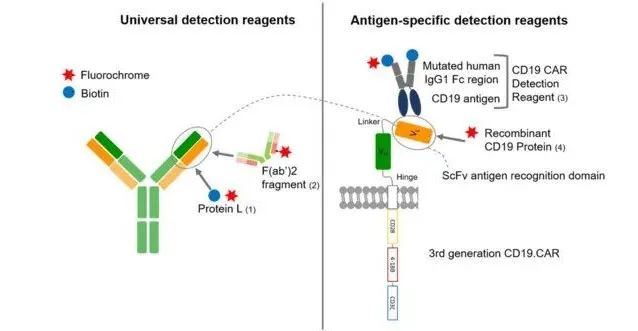
嵌合抗原受体 T (CAR-T) 细胞疗法是一种创新且有前景的癌症治疗方法,从根本上改变了免疫治疗领域。嵌合抗原受体的基本结构包括三个主要成分:(1)源自抗体单链可变片段(scFv)的细胞外抗原特异性结构域;(2)跨膜结构域;(3) 介导下游信号的胞内结构域。这种基本结构仍然是一个标准,但随着 CAR 的发展,不同代的 CAR 已经进化。 对于商业和学术环境中的CAR-T细胞制造,实施了严格的法规以确保质量、安全性和有效性。质量控制检测必须经过验证,并需要根据流式细胞术和聚合酶链反应 (PCR) 的当前状态对CAR-T细胞的转导效率和每个细胞的载体拷贝数进行体外测试。 在临床环境中,监测输入的CAR-T细胞对于确定持久性和增殖至关重要,这两个关键机制决定了CAR-T细胞在体内的抗肿瘤功效。除了令人印象深刻的治疗潜力之外,CAR-T 细胞还可以诱导显着的毒性。激活后,CAR-T 细胞会释放细胞因子,这可能导致潜在的危及生命的细胞因子释放综合征。此外,肿瘤靶向细胞还可以表现出对靶标外的肿瘤效应,描述了表达靶抗原的非恶性组织的攻击。为了阐明这些副作用,阐明无反应或复发机制并开发CAR-T细胞疗法,需要可靠的检测方法。在临床环境中监测输注CAR-T细胞的最常用方法是流式细胞术和使用CAR特异性引物的qPCR。 定量PCR可以在基因组水平上检测CAR载体,而流式细胞术可以评估细胞表面CAR分子的蛋白质表达。流式细胞术不仅可以评估CAR-T 细胞的存活率,还可以对这些细胞的免疫表型特征进行多参数分析. 本研究的目的是比较四种不同的CAR-T细胞检测试剂与流式细胞术测量CAR-T细胞频率,以及比较两种最常用的技术:流式细胞术和定量 PCR。这项工作中使用的流式细胞术检测试剂是抗原特异性或非抗原特异性的,要么直接用荧光染料标记,要么需要二次染色。 图 1. 不同 CD19.CAR 检测试剂的结合机制。通用检测试剂Protein L (1)和F(ab')2片段 (2) 与免疫球蛋白轻链和免疫球蛋白的Fab部分结合。抗原特异性检测试剂(3和4)与scFv的CD19结合位点结合。这些试剂要么直接与荧光染料偶联,如重组CD19蛋白(4)和 F(ab')2片段(2),要么与生物素偶联,后者与抗生物素抗体或荧光染料偶联的链霉亲和素在第二个染色步骤中作为CD19 .CAR检测试剂(3)和Protein L。CD19.CAR 由融合到CD28和4-1BB共刺激结构域的CD3ζ细胞质结构域组成。由接头分隔的轻链和重链可变域(VL和VH)正在构建单链可变片段 (scFv),该片段通过铰链区连接到跨膜域。 抗原特异性检测试剂与 CD19.CAR 的抗原结合域结合,与非抗原特异性检测试剂相比,应该具有高特异性和低背景染色。然而,它们很昂贵并且只能用于一种特定的 scFv。 CD19.CAR 检测试剂 (Miltenyi) 构成一种基于生物素化抗原的融合蛋白,可通过与荧光染料偶联的抗生物素抗体进行检测。它由人CD19 胞外域和突变的人 IgG1 Fc区组成。据制造商称,突变的人IgG1 Fc区不需要Fc受体阻断,并允许在低背景下染色。FITC标记的人类CD19 (20-291) 蛋白 (AcroBiosystems) 是一种重组蛋白。目标抗原已经预先用荧光染料标记。 通用CAR检测试剂,如抗Fab抗体和蛋白L,是非抗原特异性的,因此可用于不同设计和抗原特异性的CAR。两者都针对IgG样片段。虽然它们更具成本效益,但另一方面它们的特征可能是更高的背景染色 。 抗小鼠IgG Fab抗体与G类免疫球蛋白的Fab部分结合。通过对整个免疫球蛋白进行胃蛋白酶消化,大部分Fc片段已被去除,从而产生具有两个抗原结合区的二价 F(ab’)2片段,通过二硫键连接。由于Fc片段的丢失,可以大大减少与Fc受体的非特异性结合。由于这些是多克隆抗体制剂,不同批次的结果可能会有很大差异。 源自大消化链球菌的蛋白L可选择性地与大多数免疫球蛋白轻链(κ 链)亚型结合,而不会干扰抗原结合位点。该蛋白质具有广泛的免疫球蛋白结合活性,包括对Fab片段的亲和力,与类别特异性重链无关。郑等人已经证明了这一点。适用于多种CAR,包括抗EGFRvIII、抗 CD19和抗HER2。它与单链抗体片段 (scFv) 结合而不干扰免疫球蛋白的抗原结合位点,使其能够检测CAR的细胞表面表达。在用荧光染料偶联的链霉亲和素染色之前,包括多个洗涤步骤以避免在洗涤缓冲液中残留蛋白质L是很重要的。 02 关键试验结果 -Result -
3.1. 四种不同检测试剂的比较
通过四种不同的 CAR-T 细胞检测试剂对 5 名患者和 5 名 HD 制造的 CAR-T 细胞进行染色。根据染色方案对样品进行染色,并使用相应的非转导对照获得至少100,000 个事件(补充材料图 S1)。使用直方图设置设置阳性CD19.CAR的门,CAR 阳性和阴性群体由两个不同的峰分隔。
图 S1:检测试剂比较的门控策略。来自HD的CAR-T细胞样本的代表性门控策略,用于分析不同的检测试剂。所有存活的单细胞都被门控CD3阳性,然后分析CD19.CAR表达。
图S3:特异性评估的门控策略。用于分析不同检测试剂特异性的HD外周血样本的代表性门控策略。所有可行的单细胞都针对CD20和CD14阴性进行门控。然后进一步分析这些细胞的CD3阳性和CD56阴性,最后分析其CD19.CAR 表达。
如图2所示,所有试剂都可以用CD19检测试剂检测CAR,CD19蛋白和L蛋白显示出阳性和阴性群体的明显区分。CAR-T 细胞的百分比在检测试剂之间有所不同。CD19 CAR检测试剂和 F(ab’)2 片段产生了最高频率的CAR-T细胞。这些观察结果与来自健康供体 (HD) 和患者的 CAR-T 细胞一致。
图 2. 检测CD19特异性CAR-T细胞的四种不同抗体的比较。两张图都显示了使用展示的染色试剂时CAR-T细胞检测的不同百分比。(A) 描述了从五个不同的HD样本中产生的CAR-T细胞的百分比。(B) 显示了从五个不同的患者样本 (Pat) 产生的CAR-T细胞的百分比。(C) 显示了用所有四种不同抗体染色的一种HD的CAR-T细胞的等高线图。非转导细胞的门限与相应的 CD19.CAR-T 细胞组相同。分别在三个独立实验中评估HD和患者样本的比较。 3.2. 灵敏度 为了检查不同试剂的灵敏度和检测水平,CD19 特异性 CAR-T 细胞以六种不同的稀释度(1:0、1:1、1:5、1:10、 1:50、1:100、1:1000)。用四个 HD 产生的 CAR-T 细胞重复实验。排除死细胞后,分析CD3+/CD14-细胞的 CAR 表达(补充材料图 S2)。通过流式细胞术获得最少 150,000 个事件。 所有检测试剂在整个稀释1:1到 1:100 中都显示出类似的染色模式(图 3A)。通用检测试剂和CD19蛋白在 1:1000和PBMC组中都显示出更高的背景染色。即使在非常高的稀释度(50:1、100:1、1000:1)中,CD19 CAR 检测试剂也能对 CD19 CAR 阳性细胞进行特异性染色,如图 3B 所示。 图 3. 检测试剂检测PBMC中CD19特异性CAR-T细胞的灵敏度。图 (A) 显示CD19 特异性CAR-T细胞在相同HD的PBMC中以六种不同稀释度(1:1至1:1000)连续稀释。该图显示了来自四个HD的CAR-T细胞对 PBMC 的平均值±标准误差。(B)点图显示从四个不同HD之一获得的代表性数据。数据代表在一项实验中获得的四种不同的HD。 3.3.特异性 为了评估非特异性结合,来自八个不同供体的 1 × 106 PBMC 用各自的检测试剂染色,并记录了至少 150,000 个事件。PBMC 基于存活率进行门控,然后排除 CD14+、CD20+ 和 CD56+ 细胞。分析了 CD3+ 细胞的 CAR 表达(补充材料图 S3)。F(ab’)2 抗体、CD19 蛋白和蛋白 L 在仅对 PBMC 染色时显示出假阳性事件。相比之下,CD19 CAR检测试剂几乎没有表现出非特异性结合。差异非常显着(图 4)。 图 4. 不同检测试剂的特异性。PBMC用各自的CAR检测试剂染色以评估背景染色。(A) 仅显示了八个不同供体的PBMC中CD19.CAR-T 细胞的百分比。(B)显示用不同检测试剂染色的一个供体的结果。数据代表在一项实验中获得的八种不同的HD。 3.4.流式细胞术和 qPCR 在 CD19.CAR-T 细胞检测中的比较 qPCR 能够在基因组水平上检测 CAR,并在细胞表面进行流式细胞术 CAR 表达。我们将基于流式细胞术的 CAR-T 量化与之前发布的基于 qPCR 的方法进行了比较 [16]。为此,我们从三种不同的 HD 中生成 CAR-T 细胞并进行连续稀释(1:0、1:1、1:5、1:10、1:50、1:100、1:1000)。将系列稀释调整为通过转导效率测量的 CAR 转导细胞的数量。 FACS 数据直接以 % 测量。通过将每个稀释度的拷贝数结果除以未稀释的 CAR T 细胞样本并乘以 100,将来自 qPCR 实验的数据转化为 %。正如图 5 所示的数据所证明的那样,两种方法的结果在整个稀释范围内都是一致的。在大多数稀释组中,使用 qPCR 时可以测量到略高的 CAR T 细胞频率,这可能是由于非活细胞的背景噪音。对这一点概述的转导效率的测量是基于可行的 CD3+ 群体内的门控。然而,我们基于 qPCR 的分析使用样本来源 DNA 的总量,包括来自任何有核细胞成分的 DNA。为了进行更准确的比较,这种特殊的转导效率在活单线态的亲本群体中被门控,而不是活的 CD3+/CD14- 细胞。 图 5. 使用流式细胞术和qPCR进行CAR-T细胞检测的比较。CD19.CAR-T细胞以六种不同的稀释度(1:1到1:1000)进行稀释,并将百分比与使用CD19 CAR检测试剂的流式细胞术或qPCR进行比较。使用三种不同的HD进行了实验并产生了相似的结果。 03 讨论 - Dicussion - CAR T细胞疗法被认为是癌症免疫疗法的重大科学突破。随着过继性CAR-T细胞疗法的获批,迫切需要一种可靠且省时的方法来检测和分析CAR-T细胞。这对于临床医生监测接受CAR-T细胞治疗的患者外周血中的CAR-T细胞,以及CAR-T细胞生产基地对CAR-T细胞产品的质量控制具有重要意义。此外,CAR-T细胞分析也是蓬勃发展的临床前研究领域的基础。 追踪外周血中CAR-T细胞以及分析制造的CAR-T细胞的能力对于更好地了解临床疗效和阐明临床结果差异甚至治疗失败的模型至关重要。临床疗效取决于CAR-T细胞的扩增和持久性,因此会影响与治疗相关的决策。 在这项研究中,我们使用流式细胞术和定量PCR通过不同的检测方法分析了CAR表达。从HD和患者外周血样本中生成CAR-T细胞后,用四种不同的检测试剂分析CAR-T细胞,以优化流式细胞术染色。 对于CAR-T细胞检测,使用抗原特异性和非抗原特异性试剂。常用的非抗原特异性CAR染色试剂靶向IgG样片段,因此可以对范围广泛的不同scFv进行染色.Protein L和 F(ab’)2片段都是便宜的染色方法。然而,这两种方法都显示出与IgG样蛋白的交叉反应,导致非特异性染色。因此,在流动染色缓冲液中彻底清洗和/或使用FBS是必要的。此外,染色必须分几个步骤进行,避免其他T细胞染色抗体与scFv染色之间的接触。 已开发出特定的CAR-T细胞检测试剂,用于检测转导的T细胞,这些T细胞被设计为在细胞表面表达CAR,可识别特定抗原。由于抗原特异性,预计染色背景较低;然而,这些试剂很昂贵,并且只能用于一种特定的scFv。 除了特异性和成本效益外,染色时间和多功能性也很重要。直接与荧光染料偶联的检测试剂可缩短染色时间,而生物素化试剂则需要使用与荧光染料或抗生物素抗体偶联的链霉亲和素进行第二次染色。这更耗时,但在流式细胞仪面板设计方面更具通用性。 此外,CD19.CAR检测试剂在PBMC中显示出明显较低的背景染色。与其他有核细胞相比,这对于CAR-T细胞数量相当少的患者样本尤其重要;在CAR-T细胞治疗后的后续随访时间点,患者样本中通常会出现一个问题。此外,该检测试剂产生了最高频率的CAR-T细胞,并可以可靠地区分表达CAR的细胞和阴性细胞。这在没有生物阴性CAR对照的样本中非常重要,这通常由学术环境中的非转导样本提供,但缺乏患者样本。此外,CD19特异性试剂允许区分不同类型CAR的免疫表型,并且很容易与多参数流式细胞术中的抗体面板兼容。 除流式细胞术外,qPCR还可用于分析CAR表达。qPCR可以轻松提供有关扩增和动力学的基因组水平信息,还可以检测外周血中极少量的CAR-T细胞。莫德等人通过使用qPCR证明在输血后 2 年持续缓解的患者中检测到CD19特异性CAR-T细胞。此外,监管机构要求qPCR通过量化所谓的载体拷贝数(VCN)——每个基因组的平均载体拷贝来评估制造的CAR-T细胞的安全性。流式细胞术和PCR两种技术的结合, 可能建议区分缺乏CAR-T细胞持久性和抗原结合 CAR下调。尽管qPCR在临床环境中得到广泛应用,但应注意以下缺点。由于CAR表达依赖于多种因素,例如DNA甲基化、选择的启动子和启动子特异性,qPCR 常常高估了功能性CAR-T细胞的数量。根据我们的数据,通过CD19检测试剂染色并通过流式细胞术测量的CAR-T细胞的频率与qPCR结果显示出良好的相关性。在qPCR中观察到CAR表达的频率略高。 总之,所有CAR检测试剂都提供了可靠的CAR-T细胞检测。流式细胞术对CAR-T细胞产品的质量控制,应选择CAR-T细胞检测试剂区分CAR-T阳性表达和阴性细胞。此外,为了监测CAR-T细胞频率相当低的患者样本中的 CAR-T细胞,应优先选择具有低非特异性结合的检测试剂。
